Vilka elektronbanor är upptagna i en kolatom i grundtillståndet?
Vilka elektronbanor är upptagna i en kolatom i grundtillståndet? Ange kvanttalen n, l, ml och s för varje elektron.
Hur tänker man här?
Hur har du tänkt själv? Det står i Pluggakuens regler att du skall visa hur du har försökt och hur långt du har kommit. /moderator
Hur många elektroner får plats i det innersta skalet? Hur många elektroner får plats i det andra skalet? Behöver man lägga några elektroner i det tredje skalet?
Har du lärt dig hur kopplingen är mellan periodiska systemet och vilka orbitaler elektonerna finns i?
Smaragdalena skrev:Hur har du tänkt själv? Det står i Pluggakuens regler att du skall visa hur du har försökt och hur långt du har kommit. /moderator
Hur många elektroner får plats i det innersta skalet? Hur många elektroner får plats i det andra skalet? Behöver man lägga några elektroner i det tredje skalet?
Har du lärt dig hur kopplingen är mellan periodiska systemet och vilka orbitaler elektonerna finns i?
Jag har samma uppgift nu men förstår inte hur man ska göra. Det är väl 2 elektroner i k skalet och 4 i L skalet, hur ska jag gå vidare från dethär?
Erika.22 skrev:
Jag har samma uppgift nu men förstår inte hur man ska göra. Det är väl 2 elektroner i k skalet och 4 i L skalet, hur ska jag gå vidare från dethär?
Jo. Vad mer kan du säga om kvanttalen av dessa två i K-skalet?
Och om de fyra i L-skalet?
Pieter Kuiper skrev:Erika.22 skrev:
Jag har samma uppgift nu men förstår inte hur man ska göra. Det är väl 2 elektroner i k skalet och 4 i L skalet, hur ska jag gå vidare från dethär?
Jo. Vad mer kan du säga om kvanttalen av dessa två i K-skalet?
Och om de fyra i L-skalet?
Jag såg en video och det stod att i l- skalet har en s-orbital och tre p-orbitaler, nu är jag helt förvirrad, förstår inte din fråga heller.
Erika.22 skrev:
Jag såg en video och det stod att i l- skalet har en s-orbital och tre p-orbitaler, nu är jag helt förvirrad, förstår inte din fråga heller.
Läs din bok istället. Det står alldeles säkert något om kvanttalen n, l, ml och s.
Pieter Kuiper skrev:Erika.22 skrev:
Jag såg en video och det stod att i l- skalet har en s-orbital och tre p-orbitaler, nu är jag helt förvirrad, förstår inte din fråga heller.
Läs din bok istället. Det står alldeles säkert något om kvanttalen n, l, ml och s.
Jag har ingen bok, jag har komvux :(
Erika.22 skrev:
Jag har ingen bok, jag har komvux :(
Du skrev att du hade denna fråga som uppgift nu. Då har dessa kvanttal säkert behandlats i kurslitteratur.
Som man då kanske måste skaffa själv om man går Komvux.
Pieter Kuiper skrev:Erika.22 skrev:
Jag har ingen bok, jag har komvux :(
Du skrev att du hade denna fråga som uppgift nu. Då har dessa kvanttal säkert behandlats i kurslitteratur.
Som man då kanske måste skaffa själv om man går Komvux.
Förlåt säger detta med all respekt men när man kommer till pluggakuten för att få hjälp är det lite taskigt och hänvisa oss till boken eller kurslitteraturen, uppenbarligen så förstår jag ju inte det, därför söker jag hjälp hos er. Så komplicerat behöver ni inte göra det, förklara enkelt bara hur man bör tänka angående uppgiften inte en uppläxning på hur man bör leta i kurslitteraturen, för den fattar jag ju fortfarande inte det är ju därför jag är här?
Jag är lite förvånad att man måste kunna det i gymnasiet.
En elektron i en orbital kring en kärna har tre ban-kvanttal och ett spinn-kvanttal.
Spinn-kvanttalet kan har två värden .
Ban-kvanttalen är huvudkvanttalet , ban-kvanttalet som beskriver rörelsemängdsmoment och det azimutala kvanttalet som beskriver rörelsemängdsmomentets orientation.
På grund av Pauli-principen kan inte alla kvanttal vara lika, alltså inte fler än två med samma ban-kvanttal.
I en väte-atom har orbitalerna med samma huvudkvanttal samma energi (så gott som om någon vill vara petig). Det är dessa "skal" där K-skalet motsvara , L-skalet motsvara , osv.
Den andra har inte med L-skalet att göra. Orbitalet med kallas också -orbitaler (har inte med spinn att göra). Vidare kallas också -orbitaler, och orbitaler med kallas -orbitaler.
I atomer med fler elektroner än helium har olika inte samma energi. Orbitalen med (s-orbitalen) ligger lägre (har större bindningsenergi) än orbitaler med (p-orbitaler) osv.
En kolatom är komplicerad. Nästa inlägg. Ska först se hur det här se ut.
Så med denna sammanfattning:
Vad mer kan du säga om kvanttalen av de två elektronerna i K-skalet?
Och om de fyra i L-skalet?
Pieter Kuiper skrev:Så med denna sammanfattning:
Vad mer kan du säga om kvanttalen av de två elektronerna i K-skalet?
Och om de fyra i L-skalet?
Är det inte att en kolatom har 6 st elektroner och 2 av dem är i k-skalet och fyra i L skalet så blir det som du sa =
N=1
l=0
ml=0
s=+/- 1/2
eller?
Ja, så det är de två i K-skalet.
Sedan de fyra i L-skalet. Gör ett försök. (Har de berättat för dig om Hunds regel?)
Pieter Kuiper skrev:Ja, så det är de två i K-skalet.
Sedan de fyra i L-skalet. Gör ett försök. (Har de berättat för dig om Hunds regel?)
Nej inget som du har nu nämnt har dykt upp, jag har även läst fysik 2 innan i skolan och inget av det här låter ens bekant, jätte konstigt.
Men den andra ska väl vara såhär:
N=2 l=0,1 ml=0,1 s=+/- 1/2
Erika.22 skrev:
Men den andra ska väl vara såhär:
N=2 l=0,1 ml=0,1 s=+/- 1/2
Spinn-kvanttalen är besvärlige här.
Visst :
Men de båda elektronerna i 2p-nivån har parallella spinn, befinner sig i två av de tre olika orbitalerna på ett sätt som inte är så enkelt att beskriva.
Frågan är felställd, anser jag. Frågan borde ha varit så att det blir rätt om man svarar 1s2 2s2 2p2.
Här ett bra diagram av elektronkonfigurationen av en kolatom: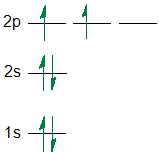 Mer än så här går inte att rita om hur elektronerna är fördelade över olika orbitaler.
Mer än så här går inte att rita om hur elektronerna är fördelade över olika orbitaler.



