vattenmolekyl
hej
kan någon snälla förklara vrf vattenmolekylen är polär kovalent bindning?
Hejsan!
Eftersom vattenmolekylen består av två ickemetaller, syre och väte, kommer dessa vilja binda till varandra med en kovalent bindning. Dvs att de delar på elektronpar. Se bilden här:
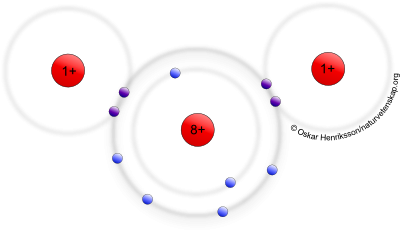
Det är på så vis som både syre och väte kan uppnå ädelgasstruktur i vattenmolekylen. Så långt är du med, visst?
Men varför är då den här bindningen polär?
Jo, har du hört talas om elektronegativitet? Det innebär att olika molekyler är olika bra på att dra till sig elektroner. De mest elektronegativa ämnena attraherar elektroner mycket väl medan de minst elektronegativa är sämre på att attrahera elektroner. Här ser du en bild på vilka atomer i PS som är mest respektive minst elektronegativa. (Rött = superelektronegativ och grön= inte så elektronegativ)
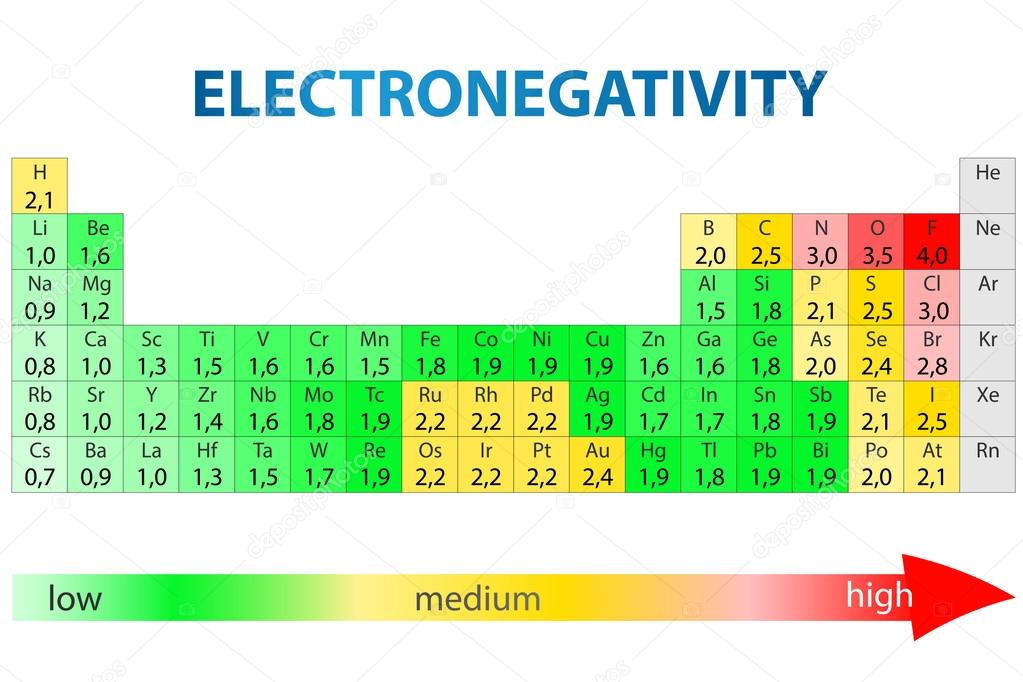
Titta nu på Väte respektive Syre som ju är de två atomslagen i vattenmolekylen.
Ser du att syre är betydligt mer elektronegativ än väte? Det betyder ju att syre är bättre på att dra till sig elektroner än väte och det är precis detta som gör bindningarna i vattenmolekylen till polära. Elektronparen som delas mellan väte och syre kommer förskjutas lite åt syrets håll (eftersom syret är bättre på att dra till sig elektroner) - då säger vi att bindningen är polär. Dvs att den inte ligger mitt emellan de olika ämnena. Tänk dig att du och din kompis håller i ett rep. Ni delar på repet och därför är båda nöjda och glada MEN du är pyttelite starkare än din kompis. Därför kommer repet vara lite lite närmre dig än din kompis när ni båda drar i det...
Att elektronerna är mer förskjutna åt syret bidrar i sin tur till att syresidan på vattenatomen blir lite mer negativ/minusladdad (elektronerna är ju förskjutna hitåt) medan vätesidan blir lite mer plusladdad/positiv (elektronerna är ju förskjutna bortifrån vätet). Därför kallas vattenmolekylen för en dipol.. för att (delta) minus och (delta) plus inte ligger på samma ställe/ sammanfaller hos molekylen.
Var det svar på din fråga? :)
3,14ngvinen_(rebus..) skrev:Hejsan!
Eftersom vattenmolekylen består av två ickemetaller, syre och väte, kommer dessa vilja binda till varandra med en kovalent bindning. Dvs att de delar på elektronpar. Se bilden här:
Det är på så vis som både syre och väte kan uppnå ädelgasstruktur i vattenmolekylen. Så långt är du med, visst?
Men varför är då den här bindningen polär?
Jo, har du hört talas om elektronegativitet? Det innebär att olika molekyler är olika bra på att dra till sig elektroner. De mest elektronegativa ämnena attraherar elektroner mycket väl medan de minst elektronegativa är sämre på att attrahera elektroner. Här ser du en bild på vilka atomer i PS som är mest respektive minst elektronegativa. (Rött = superelektronegativ och grön= inte så elektronegativ)
Titta nu på Väte respektive Syre som ju är de två atomslagen i vattenmolekylen.
Ser du att syre är betydligt mer elektronegativ än väte? Det betyder ju att syre är bättre på att dra till sig elektroner än väte och det är precis detta som gör bindningarna i vattenmolekylen till polära. Elektronparen som delas mellan väte och syre kommer förskjutas lite åt syrets håll (eftersom syret är bättre på att dra till sig elektroner) - då säger vi att bindningen är polär. Dvs att den inte ligger mitt emellan de olika ämnena. Tänk dig att du och din kompis håller i ett rep. Ni delar på repet och därför är båda nöjda och glada MEN du är pyttelite starkare än din kompis. Därför kommer repet vara lite lite närmre dig än din kompis när ni båda drar i det...
Att elektronerna är mer förskjutna åt syret bidrar i sin tur till att syresidan på vattenatomen blir lite mer negativ/minusladdad (elektronerna är ju förskjutna hitåt) medan vätesidan blir lite mer plusladdad/positiv (elektronerna är ju förskjutna bortifrån vätet). Därför kallas vattenmolekylen för en dipol.. för att (delta) minus och (delta) plus inte ligger på samma ställe/ sammanfaller hos molekylen.
Var det svar på din fråga? :)
Ja tack så många så tydligt, men om det skulle vara i samma grupp
Tänker du om de skulle ha lika stor elektronegativitet?
3,14ngvinen_(rebus..) skrev:Tänker du om de skulle ha lika stor elektronegativitet?
ja exakt
Då är ju de båda atomerna lika bra på att dra i elektronparet vilket gör att det kommer hamna mitt emellan dem. Då blir ju ingen del mer negativ eller positiv och det är bara ”en vanlig” dvs opolär kovalent bindning mellan atomerna!


