Vätgasutdrivande metaller, har jag fel?
Under mina kemilektioner har vi nyligen gått igenom redox-reaktioner och syror och baser. Väl under lektionerna som handlade om syror och baser stod det i min lärares presentation att de vätgasutdrivande metallerna, alltså de oädla metallerna oxiderade och gav oxoniumjonerna elektroner för att kunna reducera och bli vätgas.
I exemplet på presentationen användes magnesiumklorid:
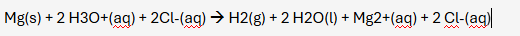
Men under lektionerna som handlade om redox-reaktioner visade det sig vara tvärtom. Där står det att de oädla metallerna hade avtagande reduktionsförmåga desto längre fram man kommer mot de ädlare metallerna, vilket inte riktigt stämmer överens med den lektionen som handlade om syror och baser.
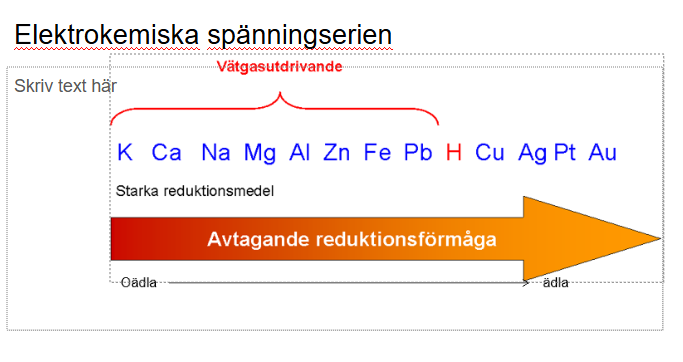
Hur kommer det sig? Kan jag på något sätt missförstått min lärares presentation?
Kan det vara så att pilen pekar åt fel håll, för nu senare i presentationen ser jag också:

Detta innebär ju att den ädla metallen reducerar ellerhur?
Nej, det betyder att den ädla metallen har en stark tendens att reduceras, så ädelmeralljonerna är oxidationsmedel som får oädla metaller att oxideras.
Du vekar blanda ihop när en metall oxideras o h när metalljonern oxiderar ett annat ämne.
Smaragdalena skrev:Nej, det betyder att den ädla metallen har en stark tendens att reduceras, så ädelmeralljonerna är oxidationsmedel som får oädla metaller att oxideras.
Du vekar blanda ihop när en metall oxideras o h när metalljonern oxiderar ett annat ämne.
Jag tror jag förstår nu. Måste ha missförstått att pilen visar att de avtar i förmåga att göra så att andra ämnen reducerar då jag trodde innan att de avtar i förmåga att sjäva bli reducerade. Ellerhur?


