Varför sker oxidation - galvanisk cell
Jag försöker förstå mig på galvaniska celler men det jag inte hittar en bra förklaring på är varför ämnet i den ena halvcellen ens oxideras till att börja med. Förklaringen jag hittar i mina läroböcker är att ämnet i den andra halvcellen är mer elektronegativt, men den förklaringen håller inte riktigt, tror jag.
Säg att vi har en galvanisk cell enligt följande diagramm:
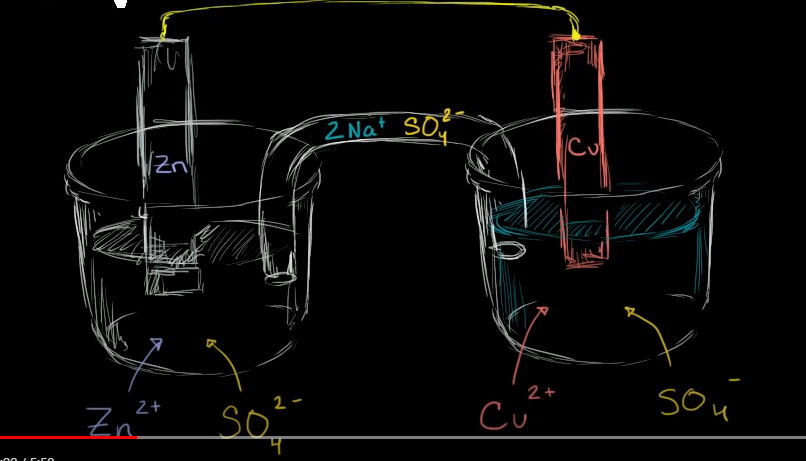
Om man endast hade kopplat ihop zinkblocket med kopparblocket hade ingen reaktion skett. Så elektrolyterna fyller uppenbarligen någon funktion. Vilken?
En annan sak jag ser gemensamt för alla galvaniska celler är att jonföreningen man löser i elektrolyten motsvarar metallen som är i elektrolyten. Exempelvis har man lagt ett zinkblock i zinksulfat, och ett kopparblock i kopparsulfat.
Det där är det klassiska exemplet på en galvanisk cell, ofta det första man kommer i kontakt med när man studerar kemi. Anledningen till det är att den är världsberömd och var en av de första galvaniska cellerna man medvetet utvecklade, ett s.k. Daniells element:
https://sv.wikipedia.org/wiki/Daniells_element
Men det var inte den första cellen, utan en förbättring av den första cellen som brukar kallas Voltas stapel:
https://sv.wikipedia.org/wiki/Voltas_stapel
Som du ser fungerar Voltas stapel på ett liknande sätt, med skillnaden att det bara finns en enda gemensam elektrolyt. Så det är absolut möjligt att konstruera en sådan cell. Många av batterierna vi använder idag - alkaliska AA-batterier, litiumjonbatterier, blybatterier m.fl. använder sig av två elektroder med en gemensam elektrolyt.
Grundprincipen oavsett uppbyggnad är att det finns ett ämne vid minuspolen (anoden) som kan oxideras, medan det finns ett ämne vid pluspolen (katoden) som kan reduceras. Elektroner kan färdas från oxidationen till reduktionen via den yttre kretsen. Problemet då är att man bygger upp en laddningsskillnad eftersom man flyttar minusladdning från den ena till den andra elektroden. Denna laddningsskillnad skulle snabbt stoppa fler elektroner från att avges om det inte vore för elektrolyten. Om negativa elektroner vandrar från anod till katod, kan negativa joner vandra från katod till anod via elektrolyten och på så sätt jämna ut laddningsskillnaderna. Det är därför det behövs en saltbrygga mellan halvcellerna som man ser i din figur. Utan den skulle inte kretsen vara sluten.
Jag vet att du även läser fysik. Har ni kommit till kapitlen som handlar om spänning, ström, resistans m.m. där man pratar om batteriers inre resistans? Den inre resistansen beror just på hur lätt jonerna kan förflyttas mellan elektrolyterna och hur lätt det är att oxidera respektive reducera ämnena inne i cellen.
Okej, så elektrolyten finns där som ett sätt att låta de andra jonerna som bildas som en konsekvens av oxidationen och de som redan finns i elektrolyterna vandra för att jämna ut laddningsskillnader?
Och finns det någon särskild anledning till att man i detta exempel just valt kopparsulfat för kopparstaven, och zinksulfat för zinkstaven? Jag förstår att exemplet är världsberömt, men jag har sett liknande samband i andra galvaniska celler.
Men min huvudsakliga fråga är fortfarande varför oxidationen sker från första början. Som jag förstår det sker den spontant i elektrolyten, så någonting får den ju att ske. Och varför vandrar elektronerna sedan genom ledaren istället för att bara stanna i anoden? Är det för att det uppstår en potentialskillnad mellan anod och katod, precis som på en vanlig elektrisk krets?
Innan man ger sig på galvaniska celler är det viktigt att förstå hur cementering fungerar, t.ex. att man lägger en bit zink i en lösning av kopparjoner vilket då får zinken att oxidera medan kopparjonerna reduceras. Är du med på det? Sen kan man såklart förklara varför detta sker och blanda in entropi, Gibbs energi osv.
En galvanisk cell fungerar egentligen på samma sätt, med skillnaden att vi vill utvinna energin som frigörs vid reaktionen som elektrisk energi och inte bara släppa ut den som värme. Om vi särar på zinkmetallen och kopparlösningen kan vi dra en ledning mellan dem så att elektroner tvingas genom en yttre krets (där vi kan utvinna en del av energin) innan de letar sig fram till kopparjonerna. För att elektronerna ska komma i kontakt med kopparjonerna behövs kopparmetallen, den leder bara ut elektronerna till lösningen. Här kan du också ganska intuitivt förstå att en större kontaktyta innebär att man snabbare kan transportera elektronerna ut i lösningen, vilket möjliggör en större ström från batteriet (det får lägre inre resistans). Det är inte viktigt att det är just koppar, utan det skulle kunna vara vilken metall som helst så länge den är minst lika ädel som koppar (annars får man en reaktion med kopparjonerna). En silverelektrod hade fungerat, men inte en järnelektrod.
Resten av cellens uppbyggnad har jag egentligen förklarat. Det sker en separation av laddningar, vilket skapar ett elektriskt fält i ledningen som hindrar fler elektroner från att vandra. Jonernas rörelser i elektrolyten förhindrar detta. men elektrolyten kan också delta i själva reaktionen, vilket är fallet med kopaprsulfatet i detta exempel.
Den andra elektrolyten som består av zinksulfat är däremot lite lurig. Det finns egentligen ingen anledning att använda just zinksulfat. Faktum är att det är en ganska dålig idé eftersom en högre koncentration av zinkjoner kommer minska cellens elektromotoriska spänning enligt Nernsts lag:
https://www.formelsamlingen.se/alla-amnen/kemi/gaser/nernsts-ekvation
En elektrolyt av natriumsulfat, som man har i saltbryggan, hade fungerat ännu bättre. Varför man ändå använder zinksulfat i nästan alla skolboksexempel kan jag inte svara på. Det kan bero på att det här som sagt är ett historiskt exempel på en berömd galvanisk cell, som inte på något vis är tekniskt fulländad. Det skulle också kunna bero på att man gillar symmetrin "zink-zinksulfat, koppar-kopparsulfat". Att det ser snyggt ut på bild, typ.
Innan man ger sig på galvaniska celler är det viktigt att förstå hur cementering fungerar, t.ex. att man lägger en bit zink i en lösning av kopparjoner vilket då får zinken att oxidera medan kopparjonerna reduceras. Är du med på det?
Nej, inte riktigt. Jag kommer ihåg någonting om någon elektrokemisk spänningsserie från grundskolan, men vi har inte gått in på just detta i Ke1-kursen. Det är dock ganska märkligt eftersom det verkar vara en så central del. Men jag antar att det har att göra med ädelhet då?
Ja, det är den elektrokemiska spänningsserien det handlar om. På gymnasiet brukar man prata om normalpotentialer istället, men det är egentligen ”elektrokemiska spänningsserien med siffror”. Det finns garanterat en tabell över normalpotentialer i din kursbok eller formelsamling.



