Varför löser salpetersyra upp silver?
Hej! Jag förstår inte riktigt varför när Ag(s) tillsätts i HNO3 (aq) bildas Ag+. Silver är väl en ädel metall? Varför sker detta med vissa syror och inte med andra, beror det på hur stark syran är? Tack
När jag gick i skolan så lärde vi oss att om man blandar salpetersyra och saltsyra så får man något som kallas Kungsvatten som löser upp det mesta. Mina övriga kemikunskaper är tyvärr noll men läs mer här:
https://sv.wikipedia.org/wiki/Kungsvatten
Ok, tack för informationen! Men det verkar vara saltsyra också där i.
Hur fungerar det med endast salpetersyra?
Det är inte vätejonerna som oxiderar silvret, utan nitratjonerna. Det är därför salpetersyra till skillnad från t.ex. saltsyra eller svavelsyra kan oxidera silver till silverjoner. Kloridjonerna eller sulfatjonerna är inte oxiderande (varm, koncentrerad svavelsyra kan dock oxidera koppar).
Salpetersyra kan däremot inte lösa guld, men blandar man salpetersyran med saltsyra fås kungsvatten och det kan lösa upp guld. Det verkar genom att nitratjonernas oxiderande egenskaper kombineras med kloridjonernas förmåga att bilda komplexföreningar med guld. Tillsammans kan dessa två egenskaper göra det möjligt att lösa upp guldet.
Liten sidenote:
Dock är det ju fortfarande viktigt att vätejonerna är närvarande i bakgrunden när man löser upp ädelmetaller med nitratjoner (och kloridjoner, när det gäller kungsvatten), även om det inte ändrar oxidationstal.
Har stött på elever som har missförstått detta och tror att natriumnitrat och natriumklorid tillsammans kan lösa upp guld! (Vilket inte fungerar!)
Visst, de oxiderande egenskaperna finns i sur lösning men det är ju nitratjonerna som är center-of-attention här till skillnad från en "vanlig" reaktion mellan en utspädd syra och en väteutdrivande metall. Nitratjoner har en viss oxiderande effekt över hela pH-skalan och kan t.ex. oxidera zink vid basiskt pH. Men förmågan är som störst vid surt pH helt klart.
Följdfråga: Varför spelar närvaron av vätejoner roll för nitratjonernas oxiderande effekt?
Undrar om inte det har någon kinetisk förklaring? Det anmärkningsvärda är att det tenderar att bildas ammoniak när nitratjoner verkar som oxidationsmedel vid basiskt pH. Ammoniak är ju den mest reducerade formen av kväve. Jämför detta med när nitratjonen verkar som oxidationsmedel vid surt pH, där man normalt får kvävemonoxid och kvävedioxid som produkter. Dessa går att reducera långt mycket längre och är inte heller de species som minimerar Gibbs energi mest om man kollar på Frostdiagrammet för kväve:
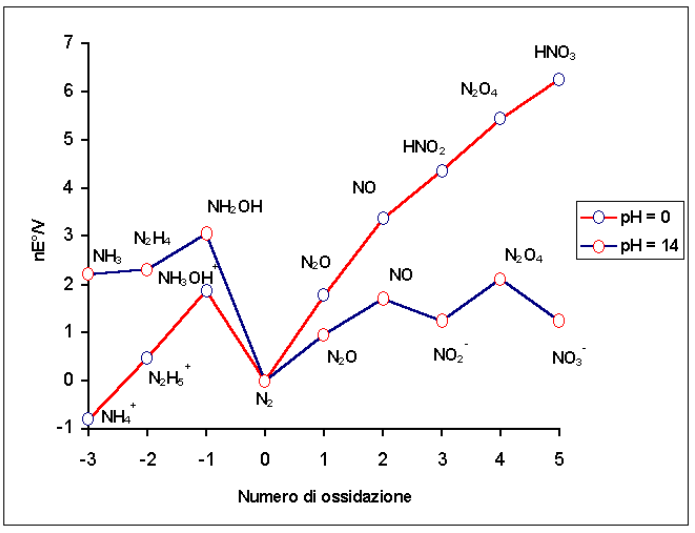
Trots att vi säger att nitratjoner är mer oxiderande vid surt pH får vi större sänkning av oxidationstal vid basiskt pH. Man kan jämföra med t.ex. permanganatjoner som också är mest oxiderande vid surt pH men även kan verka som oxidationsmedel vid basiskt pH. Där får man dock en mer reducerad species vid surt pH (Mn(II)-joner) jämfört med basiskt pH (mangan(IV)oxid).

Riktigt intressant!
Man pratar ju väldigt mycket om stabilitet (reduktionspotentialer, Gibbs fria energi osv.) när man går igenom redoxkemi på gymnasiet och i grundläggande universitetskurser, så jag har aldrig riktigt reflekterat över att kinetiken snarare än termodynamiken ofta är den avgörande faktorn för vilken redoxreaktion som faktiskt inträffar...
En relaterad fundering som jag hade när jag läste allmän kemi (för nästan 10 år sedan!) är vilken gas som bildas när man löser upp järn i svavelsyra.
Tittar man bara på termodynamisk stabilitet tycks det vara rimligare är sulfatjonerna står för oxidationen och att det bildas svaveldioxid, men i praktiken verkar det som att vätejonerna är snabbare, så att det (främst) bildas vätgas i stället.




