Varför funkar den galvaniska cellen?
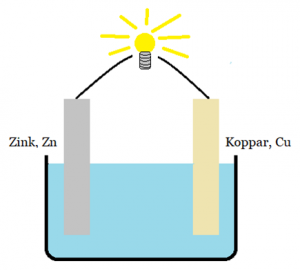
Jag undrar varför fungerar denna galvaniska cell? Är det inte enklare för elektronerna att gå från det oädlare ämnet till det ädlare ämnet via jonerna i elektrolyten? Om det är så så borde ju lampan inte lysa och den galvaniska cellen inte funka. Måste inte elektroderna vara uppdelade i olika kärl?
De måste inte vara uppdelade i olika halvceller ("kärl"), det beror på vilka reaktioner som sker. I det där exemplet skulle jag anta att det är zink som oxideras och lämnar ifrån sig elektroner. Dessa elektroner kan inte passera genom elektrolyten, utan de måste gå via den yttre ledningen till kopparblecket.
varför kan de elektronerna inte gå via elektrolyten?
Elektronerna kan inte existera fritt, de måste vara bundna till något. I ledningen är de bundna till metallatomerna som "vidarebefordrar" elektroner tills de kommer fram till kopparblecket.
men varför kan inte elektronerna vandra längs jonerna i elektrolyten?
Det måste finnas joner som kan ta upp elektronerna vid zinken - det finns inte.
Okej, så om det fanns joner vid zinken skulle elektronerna inte gå via lampan? Förlåt om jag är trög...
På sätt och vis går elektronerna ut i lösningen. Nu vet vi inte vad det är för reaktioner som sker i det där elementet, men låt oss säga att elektrolyten är någon syra. Då omvandlas zink till zinkjoner samtidigt som elektroner avges till koppar via ledningen. Vid kopparblecket tas elektronerna upp av vätejoner som bildar vätgas. Det uppkommer alltså positiva joner vid zinken, och försvinner positiva joner vid kopparn. Det kan man se som att det finns ett flöde av positiva joner från zink till koppar. Det är detta som sluter kretsen och gör att strömmen kan ledas genom själva elektrolyten.
Okej tror jag fattar, tack!


