varför fel?

Jag tänker att jag kan använda
och då får jag
vilket jag får till fel svar?
Varför går det inte att göra så?
(svaret ska bli -7 grader celcius)
Du förutsätter att trycket är konstant, vilket det inte är. Du kan däremot göra såhär:
Teraeagle skrev:Du förutsätter att trycket är konstant, vilket det inte är. Du kan däremot göra såhär:
Hur vet man om den är konstant, eller inte?
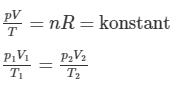
och förutsätter inte denna formeln också att den är konstant?
Det står i uppgiften att trycket ändras från 101 kPa till 80 kPa. Med andra ord är det inte konstant.
Nej, min formel förutsätter inte att trycket är konstant. Jag skrev om ideala gaslagen så att jag fick n*R i ena ledet. Detta värde är däremot konstant, eftersom R är en konstant och n (substansmängden gas) inte ändras. Vi tillför inte fler gaspartiklar helt plötsligt. Eftersom n*R är lika med p*V/T vet vi att även detta uttryck kommer vara konstant.
Teraeagle skrev:Det står i uppgiften att trycket ändras från 101 kPa till 80 kPa. Med andra ord är det inte konstant.
Nej, min formel förutsätter inte att trycket är konstant. Jag skrev om ideala gaslagen så att jag fick n*R i ena ledet. Detta värde är däremot konstant, eftersom R är en konstant och n (substansmängden gas) inte ändras. Vi tillför inte fler gaspartiklar helt plötsligt. Eftersom n*R är lika med p*V/T vet vi att även detta uttryck kommer vara konstant.
Aha okej tack! Men vad menar du med detta?
" Eftersom n*R är lika med p*V/T vet vi att även detta uttryck kommer vara konstant."
Eller det jag inte riktigt hänger med på är att trycket inte är konstant men att uttrycket är det? (Eller det som står i den meningen jag skrev av)
Är du med på pV=nRT?
Är du med på pV/T=nR?
Är du med på att nR är konstant?
Är du med på att pV/T i så fall också måste vara konstant?
Det är alltså uttrycket pV/T som är konstant, inte trycket i sig. Trycket kan ändras, men då kommer volymen och temperaturen också ändras så att uttrycket pV/T fortsatt har samma värde.
Teraeagle skrev:Är du med på pV=nRT?
Är du med på pV/T=nR?
Ja, jag är med på att man kan kasta om i formeln, men jag är dock inte riktigt med på vad man ska ha i vänsterled respektive högerled (inte just i denna frågan, men generellt).
Är du med på att nR är konstant?
Yes.
Är du med på att pV/T i så fall också måste vara konstant?
Ja för att V.L = H.L
Det är alltså uttrycket pV/T som är konstant, inte trycket i sig. Trycket kan ändras, men då kommer volymen och temperaturen också ändras så att uttrycket pV/T fortsatt har samma värde.
Ja okej, det blev klarare. Men det som återstår som frågetecken är hur man ska sätta in värdena och vad man ska ha i v.l och h.l?
Alltså i detta fallet blev det
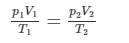
men hur man kommer fram till det och hur man vet vad man ska ha från formeln pV = nRT tycker jag är oklart..
Tanken är att man samlar alla variabler i ett led och alla konstanter i ett led. Då vet man att ledet med variablerna kommer att anta samma värde både i situation 1 och situation 2. Man sätter situation 1 lika med situation 2 och sen löser man ut den variabel man är ute efter. Man kan alltså lösa ut den nya temperaturen T2 och beräkna den, eftersom du har fått p1, p2, V1, V2 och T1 givna i uppgiften. Du har därmed allt som behövs för att beräkna T2.
Teraeagle skrev:Tanken är att man samlar alla variabler i ett led och alla konstanter i ett led. Då vet man att ledet med variablerna kommer att anta samma värde både i situation 1 och situation 2. Man sätter situation 1 lika med situation 2 och sen löser man ut den variabel man är ute efter. Man kan alltså lösa ut den nya temperaturen T2 och beräkna den, eftersom du har fått p1, p2, V1, V2 och T1 givna i uppgiften. Du har därmed allt som behövs för att beräkna T2.
Ja, men hur vet jag om jag ska använda
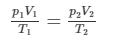
eller några samband som exempelvis
m.m?
Förstår heller inte när man ska multiplicera in/använda konstanterna dessutom?
Utgå från ideala gaslagen, den gäller alltid. Varifrån kommer din formel p1/p2=T1/T2? Har du härlett den själv?
Teraeagle skrev:Utgå från ideala gaslagen, den gäller alltid. Varifrån kommer din formel p1/p2=T1/T2? Har du härlett den själv?
Nej, min lärare har gett ut det sambandet, och även
Teraeagle skrev:Utgå från ideala gaslagen, den gäller alltid. Varifrån kommer din formel p1/p2=T1/T2? Har du härlett den själv?
Ja, men jag förstår dock inte hur och när man räknar med n, vi har inte räknat med mol i kemin än? och tycker den formeln är lite luddig (ideala gaslags formeln), alltså vet inte när jag ska använda vilket uttryck och hur man ställer upp? (eller känns iallafall lite ? )
Rent allmänt när du använder en formel måste du veta under vilka förutsättningar den gäller, man kan inte bara ta en formel som innehåller det man är ute efter och "stoppa in värden på chans". Då är risken stor att det blir fel. Har inte läraren beskrivit någonstans vad som krävs för att du ska kunna använda dessa formler?
Har ni gått igenom ideala gaslagen (även kallas allmänna gaslagen)?
Teraeagle skrev:Rent allmänt när du använder en formel måste du veta under vilka förutsättningar den gäller, man kan inte bara ta en formel som innehåller det man är ute efter och "stoppa in värden på chans". Då är risken stor att det blir fel. Har inte läraren beskrivit någonstans vad som krävs för att du ska kunna använda dessa formler?
Har ni gått igenom ideala gaslagen (även kallas allmänna gaslagen)?
Ja, asså det var ganska ytligt. Vi har gått igenom en liten del, tror det blir mer efter lovet. Men vart kan jag läsa på om det (alltså rekomenderar du någon bra källa/video) (: ? Eller finns det någon som har det på huvudet och kan förklara hade jag uppskattat det mycket!
Teraeagle skrev:Utgå från ideala gaslagen, den gäller alltid. Varifrån kommer din formel p1/p2=T1/T2? Har du härlett den själv?
Det är charles lag,
och de ytterligare lagar jag skrev om är boyles lag, och gay-lussacs lag
Under vilka förutsättningar gäller dessa lagar?
Teraeagle skrev:Under vilka förutsättningar gäller dessa lagar?
Det är som du sa - man förusätter att antigen tryck, volym eller temperatur är konstant. (Beroende på vilken lag)
Boyles - (temp konstant)
Charles lag - (volym konstant)
Gay-lussacs - (p konstant)


