Varför får nedsänkta siffran ändras ibland?
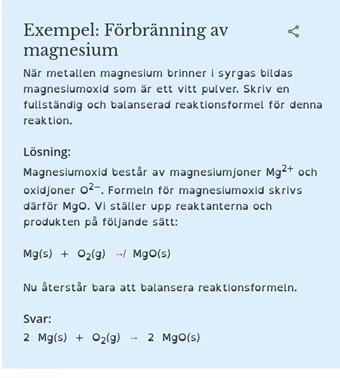 Jag förstår varken den här uppgiften, eller liknande för den delen. Utan att titta på lösningen ville jag skriva (ej satt ut aggregationstillstånden nu).
Jag förstår varken den här uppgiften, eller liknande för den delen. Utan att titta på lösningen ville jag skriva (ej satt ut aggregationstillstånden nu).
Mg2+ + O2- -> MgO och jag tänkte då att det var klart.
När jag tittar på lösningen blir jag dock bara mer förvirrad, eftersom dem skriver om magnesium och oxidjoner i förklaringen. Samtidigt nämns det inget om joner i reaktanterna. Har det och göra med att det är en förbränning med syrgas?
Ytterligare något som förvirrar mig är varför den nedsänkta tvåan kan försvinna vid produkten, eftersom jag förstått det som om man inte får ändra den någon gång. Hur ska jag då veta när man får ändra nedsänkta siffran?
Jonerna bildas vid reaktionen, så du kan inte ha dem före reaktionen (då har det ju inte skett någon reaktion). I uppgiften står det att magnesium reagerar med syrgas. Med magnesium avses metalliskt magnesium, vilket består av magnesiumatomer (Mg), inte magnesiumjoner. Med syrgas avses syremolekyler, O2.
När reaktionen sker avger magnesium elektroner till syre så att det bildas magnesiumjoner och oxidjoner (syrejoner). Dessa bildar en jonförening, magnesiumoxid.
För reaktionsbalanseringens del kunde det lika gärna ha stått 2O, dvs. två syreatomer, men de sitter ju vanligtvis ihop i en syremolekyl O2. Om de båda atomerna går skilda vägar i reaktionen så finns det ingen O2 längre, utan man hittar dem i varsin produkt. Här är det två exemplar av MgO.
Jag vet ingen anledning att vara tveksam till att ändra en nedsänkt siffra. Det kanske finns något jag inte kommer på.
Teraeagle skrev:Jonerna bildas vid reaktionen, så du kan inte ha dem före reaktionen (då har det ju inte skett någon reaktion). I uppgiften står det att magnesium reagerar med syrgas. Med magnesium avses metalliskt magnesium, vilket består av magnesiumatomer (Mg), inte magnesiumjoner. Med syrgas avses syremolekyler, O2.
När reaktionen sker avger magnesium elektroner till syre så att det bildas magnesiumjoner och oxidjoner (syrejoner). Dessa bildar en jonförening, magnesiumoxid.
Skulle man kunna skriva det som ett mellan led, även fast det inte är korrekt skrivet sätt tänker jag att jag kan skriva ut det nu för att förstå stegen som leder till MgO jonföreningen
Mg (s) + O2 (g) --> (Mg 2++ O2-2)-->/ MgO
Jag fattar fortfarande inte riktigt hur jag ska veta att det blir dem reaktanterna. Det krävs en Mg 2+ för varje oxidjon, eller?
Får jag när som helst ändra den nedsänkta siffran för att balansera en reaktionsformel?
Sen förstår jag verkligen inte heller hur jag kan apliccera den kunskapen till ett liknande case
Bellis003 skrev:Teraeagle skrev:Jonerna bildas vid reaktionen, så du kan inte ha dem före reaktionen (då har det ju inte skett någon reaktion). I uppgiften står det att magnesium reagerar med syrgas. Med magnesium avses metalliskt magnesium, vilket består av magnesiumatomer (Mg), inte magnesiumjoner. Med syrgas avses syremolekyler, O2.
När reaktionen sker avger magnesium elektroner till syre så att det bildas magnesiumjoner och oxidjoner (syrejoner). Dessa bildar en jonförening, magnesiumoxid.
Skulle man kunna skriva det som ett mellan led, även fast det inte är korrekt skrivet sätt tänker jag att jag kan skriva ut det nu för att förstå stegen som leder till MgO jonföreningen
Mg (s) + O2 (g) --> (Mg 2++ O2-2)-->/ MgO
Nej, möjligen kan du skriva 2Mg(s) +O2(g) => 2 Mg2+ + 2 O2- => 2MgO(s)
Jag fattar fortfarande inte riktigt hur jag ska veta att det blir dem reaktanterna. Det krävs en Mg 2+ för varje oxidjon, eller?
Man lär sig läsa innantill. Det står att det handlar om metallen magnesium och syrgas.
Det stämmer att det kommer att vara lika många magnesiumjoner som oxidjoner, men från början finns det varken magnesiumjoner eller oxidjoner, de bildas vid redoxreaktionen.
Får jag när som helst ändra den nedsänkta siffran för att balansera en reaktionsformel?
Nej, det beror på vilket ämne som bildas.
Sen förstår jag verkligen inte heller hur jag kan apliccera den kunskapen till ett liknande case
Det kommer du att lära dig! Om du har svårt att applicera dina kunskaper i nya situationer, så fråga här!
Smaragdalena skrev:Bellis003 skrev:Teraeagle skrev:Jonerna bildas vid reaktionen, så du kan inte ha dem före reaktionen (då har det ju inte skett någon reaktion). I uppgiften står det att magnesium reagerar med syrgas. Med magnesium avses metalliskt magnesium, vilket består av magnesiumatomer (Mg), inte magnesiumjoner. Med syrgas avses syremolekyler, O2.
När reaktionen sker avger magnesium elektroner till syre så att det bildas magnesiumjoner och oxidjoner (syrejoner). Dessa bildar en jonförening, magnesiumoxid.
Skulle man kunna skriva det som ett mellan led, även fast det inte är korrekt skrivet sätt tänker jag att jag kan skriva ut det nu för att förstå stegen som leder till MgO jonföreningen
Mg (s) + O2 (g) --> (Mg 2++ O2-2)-->/ MgO
Nej, möjligen kan du skriva 2Mg(s) +O2(g) => 2 Mg2+ + 2 O2- => 2MgO(s)
Men jag fattar inte hur jag ska veta att tvåan ska sättas framför Mg från första början.
Får jag när som helst ändra den nedsänkta siffran för att balansera en reaktionsformel?
Nej, det beror på vilket ämne som bildas.
Men hur ska jag veta när jag får byta ut den nedsnta siffran och inte? Får jag alltid flytta ut den när det är en syremolekyl exempelvis. Förstår inte alls hur jag ska kunna veta att nedsänkta tvåan efter O ska tas bort
Sen förstår jag verkligen inte heller hur jag kan apliccera den kunskapen till ett liknande case
Det kommer du att lära dig! Om du har svårt att applicera dina kunskaper i nya situationer, så fråga här!
Tvivlar jag faktiskt på, fattar inte ens i den här frågan.
Smaragdalena skrev:Sen förstår jag verkligen inte heller hur jag kan apliccera den kunskapen till ett liknande case
Det kommer du att lära dig! Om du har svårt att applicera dina kunskaper i nya situationer, så fråga här!
Skulle du kunna förklara genom att dra en jämförelse till hur man ska balansera en liknande reaktionsformel med likvärdig informatio? tror jag låst mitt tankesätt och måste försöka se det på ett annat sätt.
Bellis003 skrev:Smaragdalena skrev:Bellis003 skrev:
Får jag när som helst ändra den nedsänkta siffran för att balansera en reaktionsformel?
Nej, det beror på vilket ämne som bildas.
Men hur ska jag veta när jag får byta ut den nedsnta siffran och inte? Får jag alltid flytta ut den när det är en syremolekyl exempelvis. Förstår inte alls hur jag ska kunna veta att nedsänkta tvåan efter O ska tas bort
Jag vill påstå att du alltid kan det, men jag är inte säker på vad du menar med byta ut. Har du ett exempel där du gör det och det blir fel?
Så här gör man för att balansera formeln:
- ordformel: magnesium + syrgas => magnesiumoxid
- sätt in kemiska beteckningar: Mg(s) + O2(g) => MgO
- balansera: Det är två syreatomer på vänster sida, så det behöver vara 2 syreatomer på höger sida: Mg(s) + O2(g) => 2MgO
- balansera: Det är 2 Mg på höger sida, så det måste vara 2 Mg på vänster sida: 2 Mg(s) + O2(g) => 2 MgO.
Du vet alltså inte från början att det skall vara en tvåa framför Mg(s), det märker du när du balanserar formeln.
Laguna skrev:Bellis003 skrev:Smaragdalena skrev:Bellis003 skrev:
Får jag när som helst ändra den nedsänkta siffran för att balansera en reaktionsformel?
Nej, det beror på vilket ämne som bildas.
Men hur ska jag veta när jag får byta ut den nedsnta siffran och inte? Får jag alltid flytta ut den när det är en syremolekyl exempelvis. Förstår inte alls hur jag ska kunna veta att nedsänkta tvåan efter O ska tas bort
Jag vill påstå att du alltid kan det, men jag är inte säker på vad du menar med byta ut. Har du ett exempel där du gör det och det blir fel?
Jag kanske tänker fel och vet inte riktigt hur jag ska förklara det
Men om vi tänker C8H18 + O2 =>/ CO2 + H2O
Det blir ju liksom ett helt annat ämne ifall jag skulle flytta upp 2an från CO2
Jag kanske tänker fel, men attsätta en 2 framför H2O
Kolla in mitt inlägg i FAQ-tråden, ”Vad betyder alla siffror i en kemisk formel?”:
Teraeagle skrev:Kolla in mitt inlägg i FAQ-tråden, ”Vad betyder alla siffror i en kemisk formel?”:
Ja det är vad jag menar, det går ju inte att sätta till en nedsänkt tvåa helt random för att det skulle "balansera" reaktionen sett till antalet. Eller byta ut en två till en trea för den delen heller
Nja, alltså när du ska balansera en reaktionsformel är det siffrorna framför de kemiska formlerna (koefficienterna) du ska ändra. De beskriver hur många molekyler av varje sort som deltar i reaktionen.
Jag har en liknelse med hamburgare som jag brukar dra, där man kan säga att en hamburgare består av en biff och två bröd:
1 biff + 2 bröd —> 1 hamburgare
Om vi kallar biffen för A och brödet för B skulle hamburgaren på kemispråk kallas AB2.
Bellis003 skrev:Laguna skrev:Bellis003 skrev:Smaragdalena skrev:Bellis003 skrev:
Får jag när som helst ändra den nedsänkta siffran för att balansera en reaktionsformel?
Nej, det beror på vilket ämne som bildas.
Men hur ska jag veta när jag får byta ut den nedsnta siffran och inte? Får jag alltid flytta ut den när det är en syremolekyl exempelvis. Förstår inte alls hur jag ska kunna veta att nedsänkta tvåan efter O ska tas bort
Jag vill påstå att du alltid kan det, men jag är inte säker på vad du menar med byta ut. Har du ett exempel där du gör det och det blir fel?
Jag kanske tänker fel och vet inte riktigt hur jag ska förklara det
Men om vi tänker C8H18 + O2 =>/ CO2 + H2O
Det blir ju liksom ett helt annat ämne ifall jag skulle flytta upp 2an från CO2
Jag kanske tänker fel, men attsätta en 2 framför H2O
För mig gällde frågan vad man får göra med det som står på vänstra sidan. Om det står O2 där behöver det inte stå O2 på högra sidan.
För att balansera C8H18 + O2 =>/ CO2 + H2O:
Börja med att räkna antalet kolatomer och väteatomer och sätt in koefficienter på högersidan:
C8H18 + O2 =>/ 8 CO2 + 9 H2O
Räkna antal syreatomer på högersidan och klura ut hur många syremolekyler det betyder:
C8H18 + 12½ O2 =>/ 8 CO2 + 9 H2O
Man vill att alla koefficienter skall vara heltal, så multiplicera allting med 2:
2 C8H18 + 25 O2 => 16 CO2 + 18 H2O




