Varför är detta inte en acceptal lewisstruktur?
Halloj!
Jag försöker reda ut hur lewisstrukturen för fosfatjonen PO43- ska se ut och jag har hittat några varianter som alla ger låga formella laddningar, men de är alla fel. Jag tänker så här:
Fosforatomen kommer uppenbarligen vara centralatomen, eftersom den är mindre elektronegativ än syre och mycket större. Totalt sett har vi 32 valenselektroner att fördela över molekylen. Fint nog så kan man fördela alla elektroner jämnt om man skapar enkelbindningar mellan fosforatomen och alla syre:
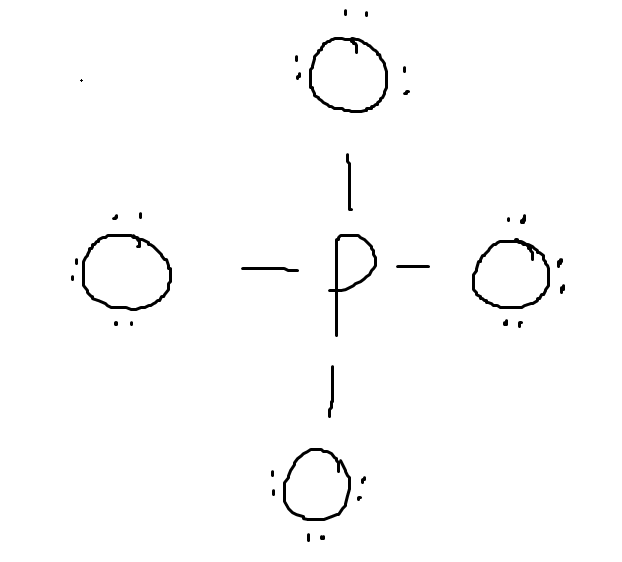
Så preliminärt har vi den här strukturen. Alla atomer uppfyller oktetregeln, och laddningen stämmer. Det går dock att sänka den formella laddningen och samtidigt behålla molekylens totala laddningen genom att flytta ett elektronpar från en syre till fosfor, eftersom fosfor har en utvidgad oktet:
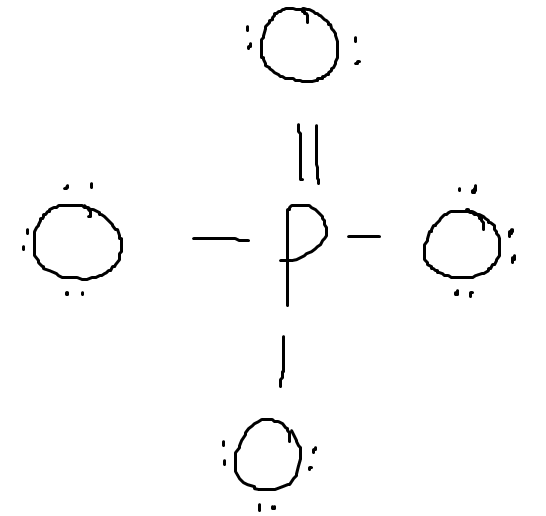
Men nu är jag lite lost. Man kan ju fortsätta göra så här med alla syreatomer, för varje gång man skapar en dubbelbindning så minskar man syrenas formella laddning med 1 men ökar fosforens formella laddning med 1, så summan bibehålls hela tiden. Så varför ska man stanna vid en dubbelbindning och inte lägga till fler?
Har det inte med geometrin att göra då? I ditt andra exempel bör fosfor vara sp3-hybridiserat, där en d-orbital används för att skapa en pi-bindning medan de fyra sp3-orbitalerna används till sigma-bindingarna. Hur skulle det se ut om det istället fanns två dubbelbindningar?
(Jag har inte tänkt djupare kring detta men det är något du kan nysta vidare i)
Nu är jag ute på djupt vatten, men jag hade själv lite av en kris över detta någon gång när jag pluggade kemi, så delar med mig av lite tankar firtt ut minnet som någon mer kunnig gärna får korrigera:
Först och främst: lewisstrukturer är väldigt grova modeller av verkligheten som utvecklades i en tid när man inte visste om orbitaler, men som trots detta ofta leder en rätt om man följer vissa regler (som i vissa fall är ganska artificiella och lite elakt kanske kan liknas vid epicyklerna som man la till för att få den geocentriska världsbilden att fungera en gång i tiden), t.ex. regeln om att hålla nere formella laddningar. Därför är de värdefulla än i dag för att snabbt få en känsla av ungefär hur olika ämnen beter sig, men ska så klart tas med en rejäl nypa salt.
I fallet med fosfat kan man som Tera skriver få en lite mer precis modell (utan att behöva gå hela vägen till mer sofistikerade molekylorbitaler) genom att tänka i termer av hybridorbitaler. Man tänker sig då fosforen som sp3-hybridiserad, och att sp3-orbtialerna bildar fyra precis likadana sigma-bindningar med syrena, som allesammans stabiliseras av något som kan liknas vid en delokaliserad pi-bindning genom den femte elektronen i fosforens valensskal, som man kan tänka sig ligger i ett d-orbital.

Hur man vill försöka fånga detta med lewisstrukturer är en närmast konstnärlig fråga. Man kan antingen rita varianten med enkelbindningarna som du föreslår, kanske slänga dit lite streckade linjer för att markera de bindningarna har extra pi-stabilisering, eller rent av försöka sig på att rita in en dubbelbindning som lewisreglerna säger att man ska göra – men då tycker jag man bör vara tydlig med att de fyra bindningarna egentligen är helt identiska på något annat sätt. T.ex. genom att påpeka det i den omgivande texten, eller genom att rita ut de olika resonansformerna, eller i vart fall ha en mental asterisk kopplad till sin figur.

Bilder från den här sidan:
Edit: En bra övning kan vara att fundera på sulfatjonen härnäst!
I fallet med fosfat är en lite mer precis modell det Tera skriver om hybridorbitaler, dvs. man tänker sig fosforen som sp3-hybridiserad, och att sp3-orbtialerna bildar fyra precis lika dana sigma-bindningar med syrena, som allesammans får lite extra pi-karaktär genom att de stabiliseras av den femte elektronen i fosforens valensskal som man kan tänka sig ligger i ett d-orbital.
Jag försökte resonera i termer av hybridisering och VB-teori förut, men det gick inte så bra. Eftersom det sitter fyra syreatomer runt fosforatomen så kan man nog räkna med sp3-hybridisering på fosforen, så långt är jag med. Men jag trasslar till det när det kommer till hur elektronerna är fördelade i orbitalerna. Om man tänker sig en sp3-hybridiserad fosforatom som inte har skapat några bidningar än skulle den ha fyra sp3-orbitaler med lika energi och fem tomma d-orbitaler i sitt valensskal. Alltså:
[Ne] 3(sp3)53d0
Men du menar alltså att en av elektronerna skulle ligga i d-orbitalen istället? Alltså att elektronkonfigurationen skulle vara [Ne]3(sp3)43d1 ?
Så borde det bli. Med en [Ne]3(sp3)53d0 struktur skulle molekylen få en pyramidal geometri då en sp3-orbital redan är fylld, dvs det skulle finnas ett fritt elektronpar på fosforatomen. Då skulle den fjärde syreatomen behöva binda med någon sorts dativbindning till en tom d-orbital vilket är orimligt.
Då skulle den fjärde syreatomen behöva binda med någon sorts dativbindning till en tom d-orbital vilket är orimligt.
Varför är det inte det? Mitt (felaktiga) resonemang tidigare var att syret skulle flytta en av sina p-elektroner så att en p-orbital var tom och sedan göra en dativbindning med fosforen. Och sedan skulle pi-bindningen också vara en dativbindning mellan en full p-orbital hos syret och en tom d-orbital på fosforen.
Men allt detta kanske höjer atomens energi ganska mycket jämfört med det andra förloppet? (en elektron i d-orbitalen från början).
Det handlar om en syreatom i så fall, vilken är elektrofil och är dålig på att donera elektroner. Det hade kunnat fungera med en oxidjon, men då hade jonen fått helt fel laddning.
Ja okej, men det är nog logiskt då. Så om man skulle rita ett diagram över orbitalerna (ritar sigmabindningarn och pi-bindningarna separat), skulle det se ut typ som nedan då?
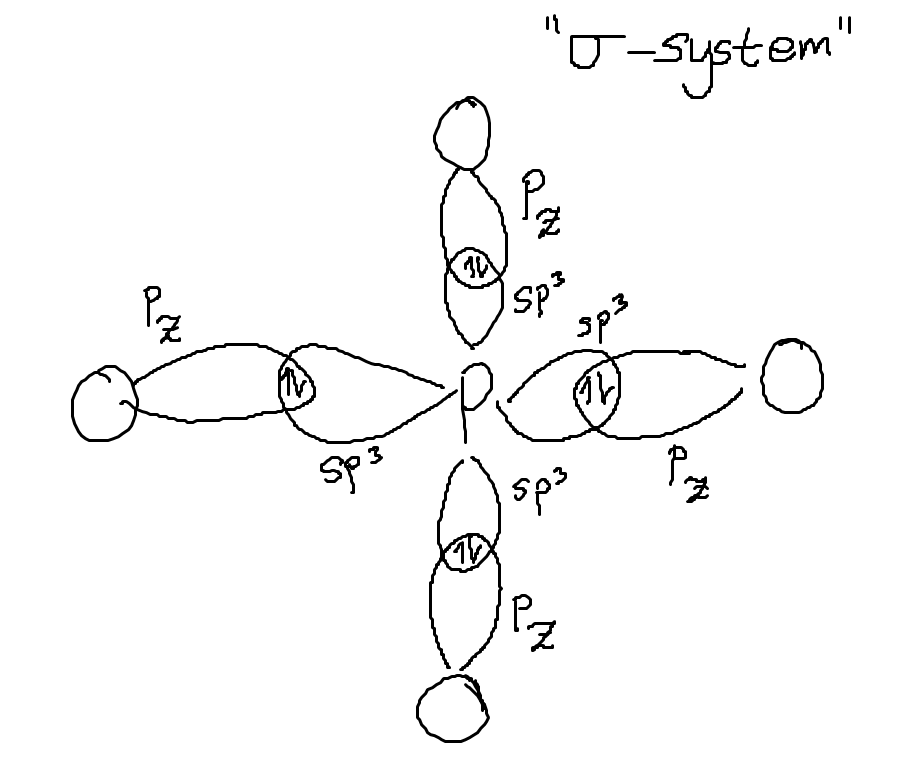
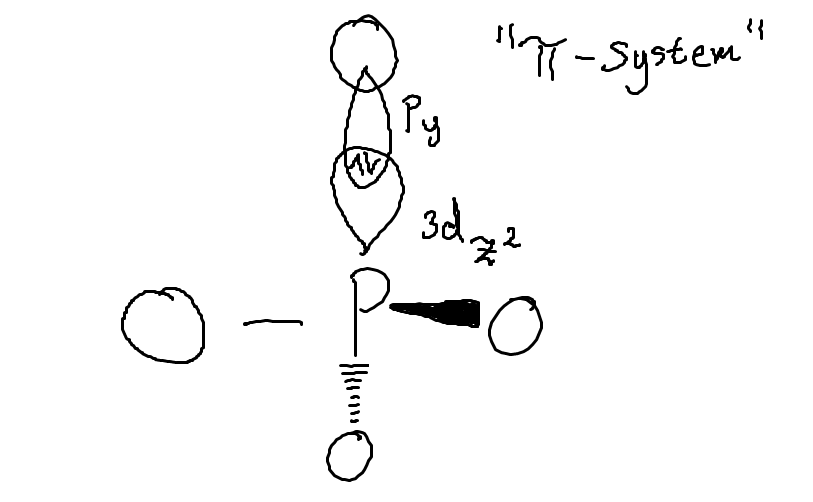
Enligt VB-teori då. Och sedan får man ju tre resonansstrukturer också, men dem ritar jag inte in här.
Jag är ute på oerhört djupt vatten nu, men jag tror man snarare ska tänka det som att d-orbitalet på fosforn överlappar med p-orbitaler hos alla syrena och bildar ett orbital som är helt symmetriskt med avseende på syrena.
För att göra detta precist behöver man nog gå in på molekylorbitaler och symmetriadaptering, som leder till väldigt intressant matematik (gruppteori och representationsteori!), men tyvärr är något jag har glömt helt från mina kemistudier.
Här är en länk med intressant diskussion och intressanta bilder där budskapet verkar vara att den här delokaliserade pi-bindningen bidrar ytterst lite (men jag kan inte uttala mig om riktigheten i det som sägs): https://chemistry.stackexchange.com/questions/13657/bonding-in-the-phosphate-ion
Jag blev nyfiken och försökte själv få fram lite MO-bilder med det här verktyget:
https://www.webmo.net/demoserver/cgi-bin/webmo/build_molecule.cgi
men jag blir inte riktigt klok på resultatet: av någon anledning visar den bara 30 fyllda orbitaler, trots att jag får det till att vi har 4*6+5+3=32 valenselektroner i spel.
Är det någon av kemiexperterna på forumet som förstår sig på detta?




