Använder de omgivningens P i allmäna gaslagen?
Halloj!
Jag håller fortfarande på att läsa om gaser och läser just nu om begreppet molvolym. I min bok står det att alla gaser, under 25 °C och 1 bar tryck, har en .
Det jag undrar är vad de menar med angivelsen 1 bar. Visst menar de att gasen påverkar sin omgivning med trycket 1 bar, inte att mätningen har gjorts i en miljö där det är trycket 1 bar?
Gasens kraft på väggen är lika med väggens kraft på gasen. Enligt Newton.
naytte skrev:Halloj!
Jag håller fortfarande på att läsa om gaser och läser just nu om begreppet molvolym. I min bok står det att alla gaser, under 25 °C och 1 bar tryck, har en .
Det jag undrar är vad de menar med angivelsen 1 bar. Visst menar de att gasen påverkar sin omgivning med trycket 1 bar, inte att mätningen har gjorts i en miljö där det är trycket 1 bar?
Molvolymen varierar alltså lite beroende på om det är högtryck elle rlågtryck, men den skillnaden spelar bara roll om man har mer än fyra värdesiffror i sina beräkningar, och i så fall kan man lika gärna räkna med "hela" idealgaslagen.
Det jag undrar är vilket tryck det är som stoppas in i formeln:
Är det gasens tryck eller är det omgivningens tryck? (det verkar vara det som Pieter svarade på, men jag förstår inte hans svar). Jag tänker att det måste vara gasens tryck, men formuleringen som används i boken som förvirrar mig lite.
Om det är en behållare där trycket är lika med omgivningens tryck är det omgivningens tryck man skall sättta in, är det en stel behållare sätter man in trycket som är inuti behållaren (som man alltså behöver mäta).
naytte skrev:Är det gasens tryck eller är det omgivningens tryck? (det verkar vara det som Pieter svarade på, men jag förstår inte hans svar).
Jag förstår inte riktigt frågan.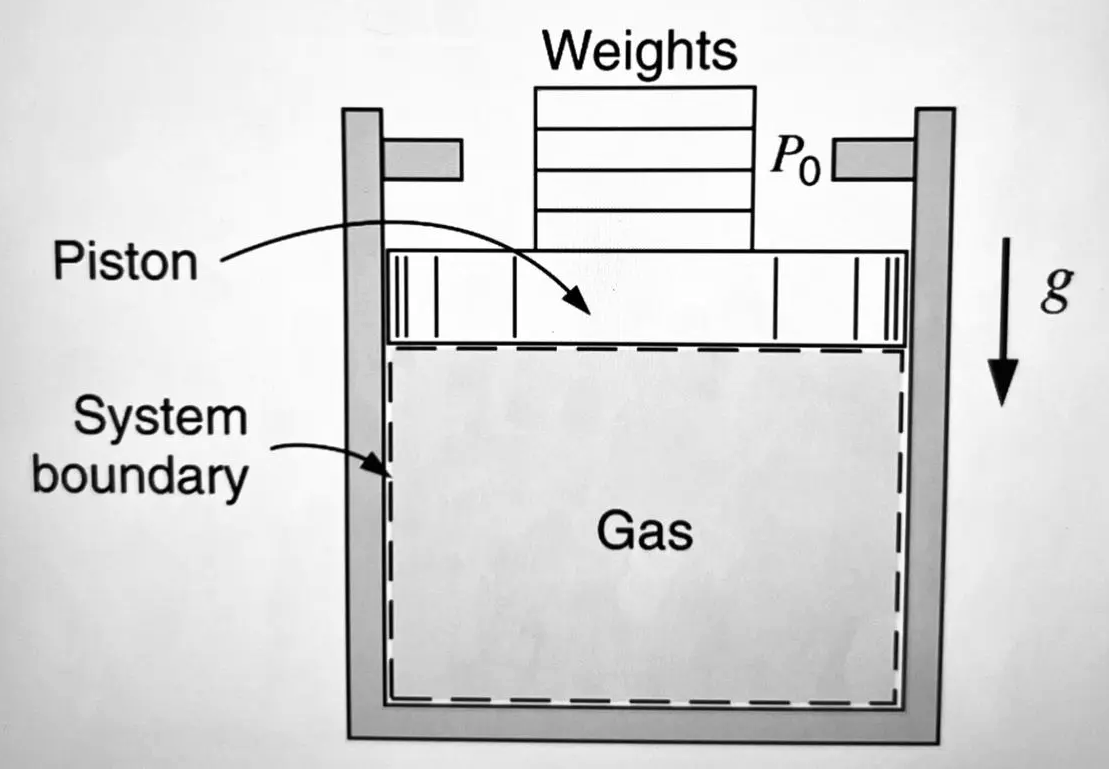 Gasen här har ett tryck, som man kan mäta med en tryckmätare (med mobiltelefonens barometer till exempel).
Gasen här har ett tryck, som man kan mäta med en tryckmätare (med mobiltelefonens barometer till exempel).
Eller man bestämmer det utifrån tyngderna på kolven och trycket utanför.
Min fråga är huruvida det är gasens tryck eller omgivningens tryck som avses i angivelserna? När man anger mätdata vid SATP menar man ju vanligtvis omgivningens tryck och temperatur, men just i det här fallet avses väl gasens tryck, eller hur?
Eller annorlunda uttryckt:
Är det gasens, vars molvolym man vill beräkna, tryck som anges med i ekvationen nedan?
Man brukar bara prata om molvolym om gasen har samma tryck som omgivningen, så det spelar ingen roll.
naytte skrev:Är det gasens, vars molvolym man vill beräkna, tryck som anges med i ekvationen nedan?
Ja.
Och i figuren ovan gav jag en situation där det inte är lika med omgivningens tryck P0. Men det är (som Newton kräver) lika med kolvens kraft på gasen delad med dess area:
Gastrycket i bildäck är typ 2,5 atm. En gascylinder (för svetsning osv) brukar ha 200 atm när den levereras.
(Jag förstår nog fortfarande inte frågan, och då hjälper det nog inte heller att jag upprepar mig.)




