Vad står "n" för i den kemiska formeln för polyeten
Som titeln säger, undrar jag vad "n" står för i (C2H4)n ?
Det står för ett stort heltal, tänk 100-tal eller 1000-tal.
Polymerer som polyeten består av långa kedjor av monomerer, men antalet kan variera från kedja till kedja. Man kan alltså inte skriva en exakt formel för ämnen som polyeten eftersom molekylerna inte ser likadana ut.
Okej. Hur skulle jag använda mig av "n"et om jag ska räkna ut hur mycket energi som frigörs vid förbränning av polyeten? och hur gör jag med det när jag balanserar formeln av förbränningsreaktionen?
Hur ser uppgiften ut?
Låt oss säga att du är på en expedition i skogen med en grupp andra studenter. Det är dags för lunch och ni behöver nu koka upp vatten till bl.a. kaffe och för att koka korv.
Din lärare tar fram tändstickor och ställer fram följande alternativ:
1. En gasbehållare med ämnet butan
2. En påse kol
3. En flaska etanol
4. En bunt gamla reklamblad (papper)
5. Matkassar i plast (polyeten)
a) Välj ut 3 av de 5 alternativen. Skriv balanserade reaktionsformler för fullständiga förbränningar av dessa.
b) Vilken av dina 3 reaktioner ger mest energi och vilken ger minst. Beräkna och motiverar med hjälp av bindningsenergier eller entalpier ur tabeller.
Jaha, den gamla klassikern!
Börja med formeln. Om du har n mol ”C2H4” i en polyetanmolekyl, hur många mol koldioxid och vatten kan du då bilda?
C2H4 + 3 O2 = 2 CO2 + 2 H2O . Så 1 mol C2H4 ger 2 mol CO2 och 2 mol H2O. Är det detta du menar?
Nästan, men det där är förbränning av eten - nu har du polyeten.
Ja men precis. Så hur räknar jag med n:et i detta?
(C2H4)n + 3 O2 = 2 CO2 + 2 H2O räcker det att jag lägger in det? eller måste jag ge n ett värde? och hur påverkar det resten av formeln i så fall?
Om du tar din första reaktion för förbränning av eten:
C2H4 + 3 O2 --> 2 CO2 + 2 H2O
Multiplicera allt med n:
n C2H4 + 3n O2 --> 2n CO2 + 2n H2O
Istället för n mol C2H4 kan vi skriva om det till polyeten, dvs n mol C2H4 som sitter ihop i en molekyl:
(C2H4)n + 3n O2 --> 2n CO2 + 2n H2O
Det är den balanserade formeln. Nu kommer nästa steg där du ska beräkna förbränningsentalpin utifrån bindningsenergier och då måste du ha koll på ämnenas strukturformler. Polyeten består av följande repeterande enhet:
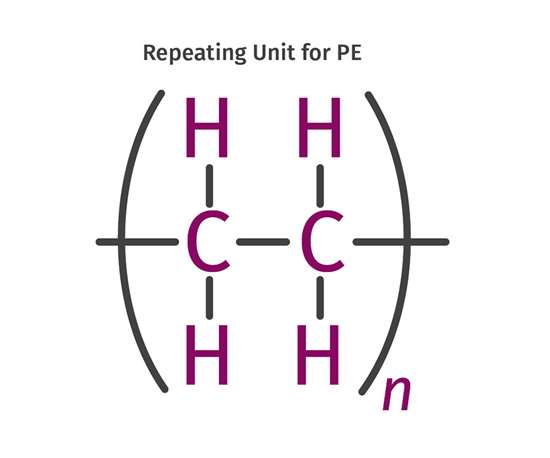
Varje enhet består av fyra C-H-bindningar och 1+2*0,5=2 C-C-bindningar (bindningarna på"kanterna" går till nya kolatomer). Räkna ut den totala bindningsenergin för dessa bindningar.
Gör på motsvarande sätt för syrgas, koldioxid och vatten.
Börja med det så får du mer hjälp sen.
Tack så jätte mycket!
Stämmer detta?
Bindningsenergi: C-H = 413, C-C = 348, O-O = 498, C=O = 805 H-O = 464
4*413 + 2*348 + 3*498 = 3842
2*805 + 2*464 = 2538
3842 - 2538 = 1304
= - 1304
Du har skrivit att du räknar bindningen i syrgas som en enkelbindning, men du har (korrekt) räknat med att det är en dubbelbindning. Antar att det bara var ett slarvfel...
Du verkar ha räknat med att det bara bildas en mol koldioxid och en mol vatten?
Ja bindningen var ett slarvfel, tack för att du fånga de :)
2*805 + 2*464 är inte detta räknat på två mol? min bok säger att bindningsenergin för CO2 är 805 kJ/mol, och för H2O 464 kJ/mol. Eller missar jag något? jag kan ju erkänna att jag känner mig ganska förvirrad...
Det är energierna för C=O och O-H bindningar, men du har ju två av bindningarna i en molekyl koldioxid respektive vatten.
Ja men det har du ju helt rätt i! Tack så jätte mycket för hjälpen, jag känner mig betydligt mindre förvirrad nu.
Hej
Kör fast i samma uppgift. Jag har kommit fram till att ∆H = n . 1094 kJ
Jag är lite förvirrad över hur man räknar det per mol när n-värdet är okänt. Tänkte beräkna massan i g för C2H4 genom att omvandla u till g och sedan beräkna hur många C2H4 enheter kan finnas i en kilogram av polyten istället av i en mol? Går det så eller jag är ute och cyklar
Du kan inte beräkna den exakta förbränningsentalpin per mol eftersom du inte vet längden på polyetenkedjorna (de är olika långa men du vet inte heller vad medellängden är).
Om du däremot utgår från t.ex. 1 kg polyeten eller en annan känd massa spelar det ingen roll hur långa kedjorna är. Du kan anta n=100 eller n=1000 och då kommer du se att förbränningsentalpin per kg blir lika stor hur du än räknar.
Vill du göra en ”snygg” generell lösning kan du helt enkelt låta bli att sätta in ett värde på n och bara räkna att molmassan är n multiplicerat med molmassan för eten. Då kommer du se att det går att förkorta bort n ur formeln innan det hela är färdigt.
Tackar mycket för svaret! Det är det som jag just tänkte på. Att det går inte att räkna förbränningsentalpin per mol. Däremot om man utgår från massan istället för substansmängden blir det antalet C2H4 enheter som är intressant och inte hur långt kedjorna är. Då oavsett vilken längd kedjorna har så kommer samma antal eten enheter finnas i en bestämd massa av polyten. Det som skiljer sig då är antalet mol per denna massa. Är det så eller blandar jag ihop detta.
Ja det stämmer.
 stämmer det?
stämmer det?
Det stämmer, men jag har två kommentarer :)
- Du har använt n för att beteckna både antalet C2H4 i en molekyl av polyeten, samt substansmängden av polyeten. Försök att använda olika beteckningar (eller använd index) så att de inte blandas ihop. Det är lätt hänt att både du själv och läsaren tror att det är samma n.
- Förbränningsentalpin ska ha ett negativt tecken. Det du har skrivit nu betyder att det tas upp 39 056 kJ/kg vid förbränning, men det är den mängden som avges (en förbränning är alltid exoterm). Svara alltså -39 056 kJ iställtet. Dessutom ska du avrunda svaret till lämpligt antal värdesiffror (fem värdesiffror är för mycket).
Väldigt tacksam för hjälpen!
Teraeagle skrev:Det står för ett stort heltal, tänk 100-tal eller 1000-tal.
Är det inte flera miljoner?
Qetsiyah skrev:Teraeagle skrev:Det står för ett stort heltal, tänk 100-tal eller 1000-tal.
Är det inte flera miljoner?
Ja det kanske det är, men poängen är att det är väldigt många.



