tryck ideala gaslagen konstanter
Frågan lyder såhär:
Trycket i en behållare är p. Hur stort blir trycket om
a) volymen halveras
b) temperaturen dubblas
c) antalet molekyler halveras
d) volymen ökar från 2,5m^3 till 3.4m^3
e) temperaturen ökar från 50*C till 100*C?
på fråga a) ställde jag upp det med ideala gaslagen:
0.5V*P = P fördubblas (2P) (räknar med temperaturen som konstant)
svaret stämmer med facit. Dock när jag använder mig med samma princip på b)
P/2T = P halveras ( Volymen blir konstant då T fördubblas och P ändras)
Blir svaret inte rätt, svaret ska vara att P fördubblas på b) också.
och på d) använder jag mig också av gaslagen :
P1*V1=P2*V2
2.5P1=3.4P2 P= 0.9 men svaret där är 0.74
All hjälp uppskattas!
Det är lite svårt att hänga med i vad du skriver, eftersom du inte är konsekvent med dina beteckningar.
Använd i stället att p*V = n*R*T, eller om du hellre vill skriva det som att konstanten R = (p*V)/(n*T)
så att
(p1 * V1) / ( n1 * T1) = (p2 * V2) / ( n2 * T2)
Bubo skrev:Det är lite svårt att hänga med i vad du skriver, eftersom du inte är konsekvent med dina beteckningar.
Använd i stället att p*V = n*R*T, eller om du hellre vill skriva det som att konstanten R = (p*V)/(n*T)
så att
(p1 * V1) / ( n1 * T1) = (p2 * V2) / ( n2 * T2)
jag ber om ursäkt kring röran, då jag har lärt mig att använda :
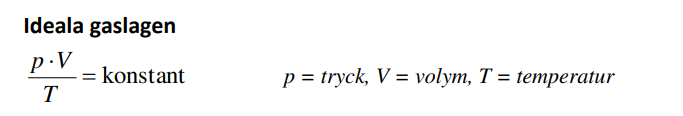
utgår jag ifrån att när tex b) när temperaturen dubblas. Att vår volym är konstant. Då blir det formlen: P/T = konstant
Du nämner P*V = n*R*T, dock är jag lite osäker hur man ska använda den när vi endast vet ( i fråga B) att temperaturen dubblas. Blir det:
(p1 * V1) / ( n1 *2T ) =
?
Vad gör man med resten av faktorerna?
I den formel du klippte in finns inte n (mängden gas) med. Den gäller för en viss mängd gas. Om man ändrar mängden gas, som man gör i deluppgift c, måste man använda någon variant av formeln jag skrev.
Frågorna är lite dåligt formulerade, tycker jag. Det man menar är
a) Mängden gas är densamma, temperaturen är densamma. Ändra bara tryck och volym.
b) Mängden gas är densamma, trycket är detsamma. Ändra bara temperatur och volym.
c) Temperaturen och volymen är desamma. Ändra bara mängden gas och tryck.
...och på liknande sätt i d) och e)
Okej, så om jag har förstått det rätt så borde det gå att använda formlen jag skickade in på a) samt b) då mängen gas förblir densamma både före och efter. Då borde det bli såhär på b):
P*V/2T =P*V/2T
frågan är dock hur man ser utifrån den ekvationen att trycket fördubblas.
Du vet ju inte att Pföre = Pefter, utan att kvoten har ett konstant värde. Om du dubblar nämnaren så måste du ... täljaren också, för att värdet skall vara detsamma.
colabirb skrev:Okej, så om jag har förstått det rätt så borde det gå att använda formlen jag skickade in på a) samt b) då mängen gas förblir densamma både före och efter. Då borde det bli såhär på b):
P*V/2T =P*V/2T
frågan är dock hur man ser utifrån den ekvationen att trycket fördubblas.
Nu står det exakt samma sak på bägge sidor likhetstecknet.
Vilka värden är "före" och vilka är "efter"?


