Titrering av bas med en syra
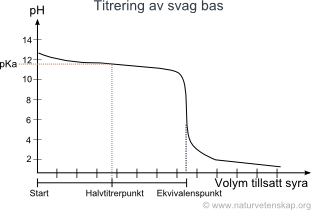
Hur blir pKa här? Är det fortfarande pka för syran?
Splash.e skrev:
Hur blir pKa här? Är det fortfarande pka för syran?
Nej, det är pKb för den korresponderande basen. När man har tillsatt hälften så mycket syra som vid ekvivalenspunkten (d v s man är vid halvtitrerpunkten) så är hälften av basen i syraform och hälften i basform oberoende av på vilket sätt man har kommit dit, men i det här fallet är det ju OH-joner de står i jämvikt med, inte oxoniumjoner.
Smaragdalena skrev:Splash.e skrev:
Hur blir pKa här? Är det fortfarande pka för syran?
Nej, det är pKb för den korresponderande basen. När man har tillsatt hälften så mycket syra som vid ekvivalenspunkten (d v s man är vid halvtitrerpunkten) så är hälften av basen i syraform och hälften i basform oberoende av på vilket sätt man har kommit dit, men i det här fallet är det ju OH-joner de står i jämvikt med, inte oxoniumjoner.
så om syran är HCL, då är den korresponderande basen CL-. Så det som är markerat vid halvtiterpunkten ungefär vid pH 12 är pKb = 11,8 ungefär? har jag förstått det rätt då
Det står på diagrammet att det handlar om titrering av en svag bas, så det är den basen som är intressant, inte kloridjonen.
Smaragdalena skrev:Det står på diagrammet att det handlar om titrering av en svag bas, så det är den basen som är intressant, inte kloridjonen.
Bara för att bekräfta, det är pkb för basen ex NaOh??
Nej, bara om det handlar om en svag bas, inte om det handlar om NaOH.


