Termokemi- isblåsa eller värmedyna
En isblåsa eller värmedyna i "fickformat" kan tänkas bestå av en plastpåse indelad i tre fack, se figur.
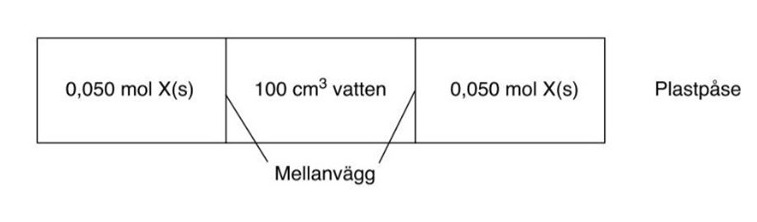
Plastpåsen innehåller 0,10 dm3 vatten och 0,10 mol av ett ämne X i fast form.
När man klämmer tillräckligt på plastpåsen går mellanväggarna sönder och det fasta ämnet X blandas med vatten och löses upp:
X(s) + H20 -> X(aq) 𝛥𝐻= +58 kJ/mol X
a) Fungerar plastpåsen med innehåll som värmedyna eller isblåsa? Motivera svaret.
Jag tänker att eftersom 𝛥𝐻 är positivt är det en endoterm reaktion. De tar upp energi från omgivningen vilket gör att temperaturen sjunker. Den fungerar som en isblåsa.
Tänker jag rätt?
b) Plastpåsen med innehåll har legat i rumstemperatur (20 °C) innan den används. Beräkna temperaturändringen när mellanväggarna bryts. Lösningen som bildas har densiteten 1,05 g/cm3. Lösningens specifika värmekapacitet är 4,2 J/g*K. Du kan anta att volymen inte ändras när ämnet X löses.
Jag tänkte såhär:
Värmekapacitet (C): 4,2 J/g*K
Densitet: 1,05 g/cm3
Volym: 100 cm3
Substansmängd (n): 0,1 mol
𝛥𝐻= +58 kJ/mol X
räkna ut massan: x/100=1,05 x=105g
räkna ut energin: x/0,1=58 kJ x=580 kJ
q=C*m*𝛥T
580=4,2*1,05*x x=1,31519274
𝛥T=1,31519274-20= -18,6848073 ≈ -18,7°C
Har jag räknat rätt med att temperaturskillnaden är 18,7°C?
a) rätt
b) Energiuträkningen är fel. Om 1 mol tar upp 58 kJ är det inte rimligt att 0,1 mol tar upp 580 kJ. Däremot tas 5,8 kJ upp.
När du sen beräknar temperaturändringen räcker det med att bestämma 𝛥T, det är temperaturändringen. Du behöver alltså inte ta hänsyn till att temperaturen är 20 grader.


