Termokemi: En iskub smälter
Hej! Detta är förmodligen ett gymnasieproblem, men det är en del av den introduktionskurs i kemi som jag just nu läser på universitet. Jag blir smått galen då jag inte lyckas lösa den, minns dessa problem från gymnasiet men tyvärr inte hur jag gjorde då!
"An ice cube of mass 50g at 0 degrees Celsius is added to a glass containing 400g of water at 45.0 degrees Celsius. What is the final temperature of the system?"
Jag tänkte att det som behövs från "isens perspektiv" är:
1. Smälta isen (den är redan vid 0 grader, så ingen uppvärming till 0 grader behövs)
2. Värma upp isen till den sökta temperatur
För vattenlösningen gäller på samma sätt:
3. Vattnet minskar temperatur från 45 grader till :
Vidare borde gälla att:
Men jag ska få 31C enligt facit, vilket jag inte får:
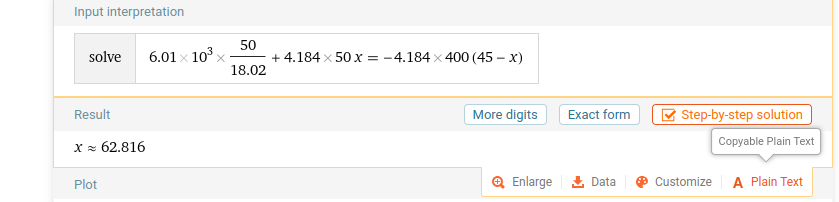
Antagligen är det bara ett väldigt simpelt misstag, men jag har försökt hitta det utan att lyckas!
Det är i steg 3 det blir fel, du räknar T1-T2 när du borde räkna T2-T1, dvs termen från detta steg borde vara 4,184*400*(Tf-45).
Jag skulle räkna så här, men det var ett par decennier sedan sist:
Energi i vattenglaset från början: 4,2*400*45 = 75600 J
Isens smältentalpi är 334 kJ/kg, så energi för att smälta den: 0,050*334*103 = 16700 J
Energi i det nya systemet (där massan är 450g): 75600-16700 = 58900 J
Åter till formeln för värmekapacitet: 58900=4.2*450*T
T ≈ 31,2
Teraeagle skrev:Det är i steg 3 det blir fel, du räknar T1-T2 när du borde räkna T2-T1, dvs termen från detta steg borde vara 4,184*400*(Tf-45).
Jaha, vad larvigt! Nu får jag detta vilket ser rätt ut:
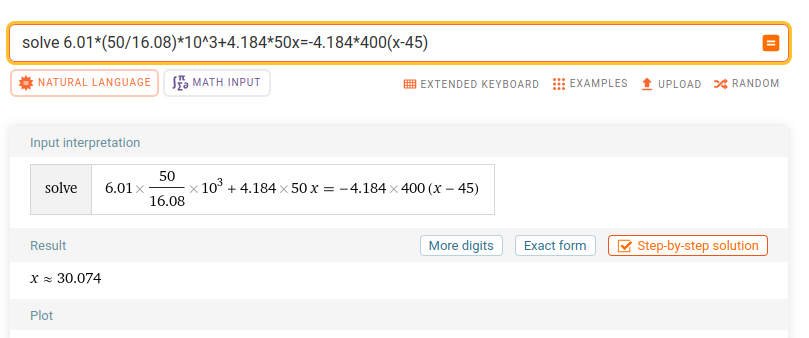
sictransit skrev:Jag skulle räkna så här, men det var ett par decennier sedan sist:
Energi i vattenglaset från början: 4,2*400*45 = 75600 J
Isens smältentalpi är 334 kJ/kg, så energi för att smälta den: 0,050*334*103 = 16700 J
Energi i det nya systemet (där massan är 450g): 75600-16700 = 58900 J
Åter till formeln för värmekapacitet: 58900=4.2*450*T
T ≈ 31,2
Jag tycker detta var ett lättare sätt att angripa problemet på, tusen tack!


