Svårt att förstå kemiska bindningar
Jag har otroligt svårt att förstå hela grejen med kemiska bindningar. Jag har verkligen försökt forska själv men det känns som alla sidor säger olika saker.
Det jag har svårt med är att förstå varför kemiska bindningar sker. Jag vet att atomer vill uppnå lägsta möjliga energitillstånd i form av ädelgasstruktur. Men hur kommer det sig att just ädelgasstruktur har ett lägre energitillstånd?
Den enda förklaringen jag fått från min kemilärare är ”elektroner hamnar närmare kärnorna”, vilket jag heller inte förstår.
det jag inte förstår är följande:
varför är ädelgasstruktur lägre energitillstånd
varför ”ger” exempelvis natriumjonen en elektron till kloridjonen i NaCl? Hur uppnår detta ett lägre energitillstånd?
lite samma sak med kovalenta bindningar - hur det uppnår lägre energitillstånd
all hjälp uppskattas oändligt mycket!! berätta gärna mer än vad som ”behövs”, det är bara kul att få lära mig mer!!
:)
varför ”ger” exempelvis natriumjonen en elektron till kloridjonen i NaCl? Hur uppnår detta ett lägre energitillstånd?
När man pratar om att ett system uppnår en "lägre energi" avser man oftast systemets sammanlagda potentiella energi. Egentligen går man in på kvantmekanik här. Atomens (valens)elektroner är bundna till de positiva laddningarna i atomkärnan genom någon form av elektrostatisk attraktion (Coulombkraft). Elektronerna har då en potentiell energi jämfört med atomkärnan (alltså måste en motritkad kraft hålla elektronerna borta från kärnan[1]).
Natriumjonen har inte en så hög effektiv kärnladdning på sina valenselektroner () medan kloridjonen har en mycket hög effektiv kärnladdning på sina (). En större kärnladdning motsvarar en större elektrostatisk kraft. Så om elektronen sticker från natriumjonen och hoppar in hos kloridjonen, så kommer elektronen komma mycket närmare kärnan i kloridjonen än i natriumjonen, och därmed sänka sin potentiella energi och därmed systemets potentiella energi.
lite samma sak med kovalenta bindningar - hur det uppnår lägre energitillstånd
Detta är ganska komplicerat men har också att göra med kvantmekanik. Vi kan ta vätgasmolekylen som exempel. Den lägsta möjliga energinivån i vätgasmolekylen har lägre energi än den lägsta energinivån i bara väte. Eftersom vi kan få in två elektroner i den energinivån så kan två väteatomer sänka sin energi gemensamt genom att dela på varandras elektroner och trycka in dem i en energinivå tillsammans. Skillnaden i energi avges som värme.
Om vi skulle föreställa oss exempelvis diatomär heliumgas så skulle en av energinivåerna vara lägre än i enatomärt helium, och en av energinivåerna vara högre. Så i genomsnitt skulle den totala energin vara samma och molekylen skulle bara bli enatomär helium igen. Det är därför helium förekommer som och inte som .
Jag har försökt göra den här förklaringen så förståelig som möjligt men det kanske är lite svårt att förstå innan ni har gått in lite på t.ex. orbitaler (om ni nu kommer göra det, har hört att inte alla gymnasier gör detta). Förhoppningsvis stämmer min förklaring nu också. Någon får gärna hojta till om jag har skrivit fel någonstans!
Formeln jag använde för att beräkna effektiv kärnladdnig är , där kallas för "the shielding constant" (≈ skärmningskonstanten). Denna approximeras med alla elektroner mellan den aktuella valenselektronen och kärnan. Detta är bara en av många modeller för effektiv kärnladdning, men exakt hur modellen ser ut spelar ingen roll. Det den måste fånga är att högre atomnummer och färre skärmande elektroner innebär en större effektiv kärnladdning.
[1] Det som gör att elektronerna inte bara dras in i kärnan utan stannar i sina energinivåer är att deras kinetiska energi närmar sig den positiva oändligheten lika fort som den potentiella energin sjunker mot negativa oändligheten. Så detta gör att elektronerna "slungas iväg" från kärnan. Notera dock att detta är en ganska förenklad modell. När man talar om elektroner i atomer och molekyler talar man egentligen inte om "partiklar" med bestämbar rörelsemängd och position, men allt detta kräver ganska komplex matematik för att förstå. För dina kemi-1-ändamål kan du nog tänka enligt den ovan utlagda modellen utan förbehåll.
När det gäller kovalent bindning kan du tänka att elektronerna antingen kan befinna sig mellan atomkärnorna eller på motsatt sida, dvs
atomkärna - elektroner - atomkärna
elektroner - atomkärna - atomkärna - elektroner
Atomkärnorna repellerar varandra, vilket motverkas av elektronerna i första fallet och man får en bindning. I andra fallet är repulsionen större och bindning är inte möjlig.
I vätemolekylen (H2) befinner sig båda elektronerna mellan atomkärnorna vilket ger en stabil bindning. I heliummolekylen (He2) finns två elektroner mellan atomkärnorna och två på sidorna. Det räcker inte för att hålla ihop atomkärnorna, bindningen uppstår inte och helium föredrar därför att finnas som fria He-atomer.
Teraeagle skrev:atomkärna - elektroner - atomkärna
elektroner - atomkärna - atomkärna - elektroner
Atomkärnorna repellerar varandra, vilket motverkas av elektronerna i första fallet och man får en bindning. I andra fallet är repulsionen större och bindning är inte möjlig.
Kan man säga att ena atomkärnan dras till den andra atomkärnans elektron och på så sätt binds de ihop?
naytte skrev:
lite samma sak med kovalenta bindningar - hur det uppnår lägre energitillstånd
Detta är ganska komplicerat men har också att göra med kvantmekanik. Vi kan ta vätgasmolekylen som exempel. Den lägsta möjliga energinivån i vätgasmolekylen har lägre energi än den lägsta energinivån i bara väte. Eftersom vi kan få in två elektroner i den energinivån så kan två väteatomer sänka sin energi gemensamt genom att dela på varandras elektroner och trycka in dem i en energinivå tillsammans. Skillnaden i energi avges som värme.
Om vi skulle föreställa oss exempelvis diatomär heliumgas så skulle en av energinivåerna vara lägre än i enatomärt helium, och en av energinivåerna vara högre. Så i genomsnitt skulle den totala energin vara samma och molekylen skulle bara bli enatomär helium igen. Det är därför helium förekommer som och inte som .
Jag har fortfarande svårt att förstå hela grejen med kovalenta bindningar. Varför är ett fullt valensskal lägre energi/mer stabilt?
Jag förstår jonföreningar och hur de uppnår lägre energi. Men det är kovalenta bindningar jag inte riktigt förstår mig på. Men tror ni att enbart säga "fullt valensskal innebär lägre energi/mer stabilitet" räcker till en förklaring för kemi 1?
Jag tycker det är lite flummigt att påstå att fulla valensskal innebär lägre energi. Vad exakt menar du med lägre energi? Det väsentliga är att systemet kan sänka sin potentiella energi genom att de ingående atomerna skapar kovalenta bindningar.
Om du vill förstå detta lite mer måste vi gå in lite molekylorbitalteori. När två atomer går ihop och skapar en kovalent bindning så ockuperar elektronerna gemensamma molekylorbitaler. När molekylorbitaler uppstår i vårt fall uppstår det en bindande orbital och en antibindande orbital . Det viktiga här är att antibindande orbitaler har högre energi än bindande orbitaler. I en molekyl som vätgas så kommer elektronerna fylla på orbitalerna på följande vis:
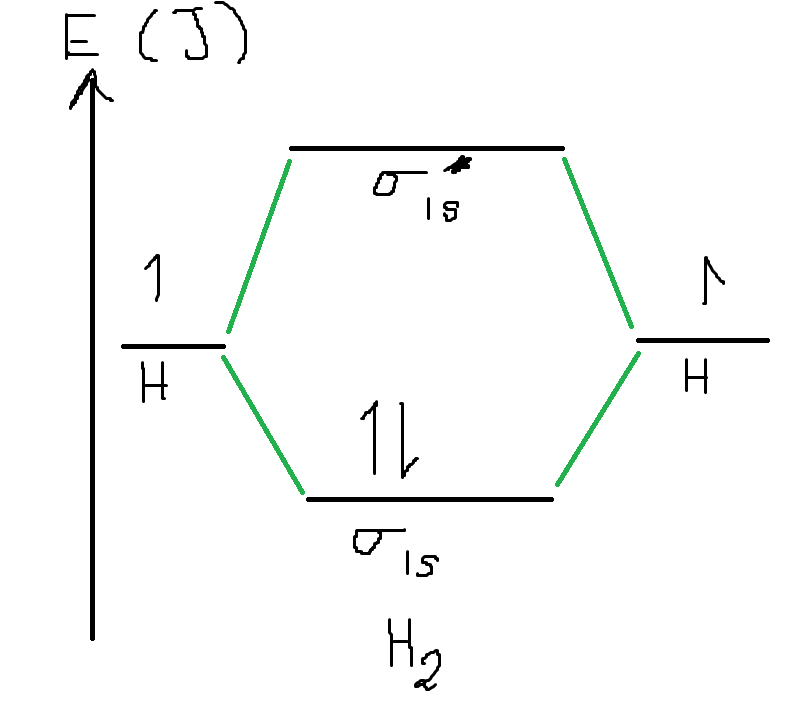
Som du ser här kan uppnå en lägre energi genom att två bidrar med varsin elektron till den bindande orbitalen. Om vi skulle göra motsvarande energidiagram för heliumgas och vår teoretiska diatomära heliumgas skulle vi se att såväl den bindande som antibindande orbitalen fylls på, och då blir snittet av energin i diatomär heliumgas samma som i enatomär heliumgas, alltså skapas det ingen bindning. Det finns en regel som säger att om bindningstalet är 0 så uppstår det ingen bindning. Bindningstal definieras som:
Om du är intresserad kan du läsa mer t.ex. här:
Tillägg: 10 okt 2024 21:07
Men detta är nog överkurs beroende på vad er kemilärare vill att ni ska lära er. Så om det känns helt nytt eller främmande kan du nog strunta i det, såvida du inte är intresserad! :D
Egentligen är det nog bäst att du frågar honom vilken typ av förklaring han efterfrågar. Det var med orbitaler osv. vi resonerade på gymnasiet, men jag har som sagt hört att det finns stor variation i vad man går igenom beroende på gymnasium.
Ok! Tack så galet mycket för all hjälp!
Min kemilärare är inte så bra på att förklara och det var nämligen så han formulerade förklaringen. :c
Då är det det du får gå efter!
Bindande och antibindande orbitaler är det jag försökte förklara med ”elektroner mellan atomkärnorna” (=bindande orbitaler) och ”på sidorna av atomkärnorna” (= antibindande orbitaler).
Se ädelgasstruktur mer som en minnesregel än en strikt naturlag. Det är egentligen ganska få ämnen som strävar efter ädelgasstruktur och till och med ädelgaserna själva kan bilda kemiska föreningar. Xenondifluorid (XeF2) är ett exempel som till och med har industriella användningsområden.
Skulle man kunna beskriva jonföreningar på följande sätt?
Jonföreningar sker då den ena atomen, exempelvis klor i NaCl, har högre elektronegativitet än natrium. Kloret ”rycker” loss/natriumet ger klor en elektron. Det bildas då en natriumjon och en kloridjon som hålls samman av elektrostatiska krafter. Elektronen som gått över till kloridjonen har lägre potentiell energi då den är närmre kärnan än vad den var i natrium. Atomer vill ha fullt valensskal eftersom det gör atomen stabilare (oktettregeln)
funkar detta till förklaring? Stämmer det jag sa med potentiella energin?
I kovalenta bindningar delar atomerna på valenselektronerna för att uppfylla oktettregeln och det är attraktionen mellan atomernas elektroner och protoner som håller de samman.
Jag markerade det jag är extra osäker på.
Tack i förhand!
Det finns många molekyler med kovalenta bindningar där atomerna inte uppfyller oktet"regeln". Ett vanligt exempel är kvävedioxid (), där kvävet får "för få" valenselektroner.
Kovalenta bindningar uppstår för att systemet kan sänka sin potentiella energi om det sker. Precis av samma skäl som jonbindningar uppstår. Jonbindningar uppstår eftersom systemet kan sänka sin potentiella energi genom att elektronerna övergår från den ena atomen till den andra.
ah ok!
men stämmer resten av min förklaring?
Vad menar du med att "de hålls samman". Vad är det som hålls samman?
naytte skrev:Vad menar du med att "de hålls samman". Vad är det som hålls samman?
Jag har inte riktigt fattat hur kovalenta bindningar ”hålls samman”. I jonföreningar hålls jonerna ihop av elektrostatiska krafter då det finns positiva och negativa joner.
men hur går det till i kovalenta bindningar?
Jaha, ja det är en elektrostatisk attraktion även där som "håller ihop" molekylen. De positiva kärnorna attraheras till de gemensamma elektronerna, om jag inte är helt ute och cyklar. Om jag talar i nattmössan får någon såklart gärna flika in!
naytte skrev:Natriumjonen har inte en så hög effektiv kärnladdning på sina valenselektroner () medan kloridjonen har en mycket hög effektiv kärnladdning på sina (). En större kärnladdning motsvarar en större elektrostatisk kraft. Så om elektronen sticker från natriumjonen och hoppar in hos kloridjonen, så kommer elektronen komma mycket närmare kärnan i kloridjonen än i natriumjonen, och därmed sänka sin potentiella energi och därmed systemets potentiella energi.
"komma mycket närmare kärnan i kloridjonen än i natriumjonen, och därmed sänka sin potentiella energi och därmed systemets potentiella energi. "
hur fungerar det vid exempelvis NaI - natriumjodid? alltså när anjonen är betydligt större än katjonen?
Det är inte bara hur nära elektronen är kärnan som avgör dess potentiella energi. Nu höftar jag lite (för jag minns inte exakt), men jag tror formeln för potentiell energi för en elektron är:
Här ser vi att mindre avstånd till kärnan leder till lägre potentiell energi, men även den effektiva kärnladdningen som elektronen känner av spelar roll!
I vårt fall ser vi då att den potentiella energin hos valenselektronen är lägre i jodidjonen än i en natriumatom, så då kan vi åtminstone förutsäga att vi får NaI, alltså Na+ och I-.
Men jag ska nämna att jag är ute på rätt djupa vatten här. Detta är ingenting jag kan jättebra så någon får mer än gärna rätta mig om jag talar i nattmössan.
Men i grunden handlar allt om att systemet kan sänka sin energi. Allt som sänker systemets energi (entalpin sjunker) är åtminstone termodynamiskt gynnsamt.



