Strukturformler
Hejsan. Jag har två frågor: Jag vet till stor del hur man målar upp en strukturformel, det jag dock är osäker på är hur man kan veta i vilken "formation" som atomerna sitter i, ex vinklad eller rak. Jag har hört att de olika elektronparen vill hamna i en så stor vinkel bort från varandra som möjligt, men denna vinkel borde väl nästan alltid vara som störst i en rak form om vi har ämnen med 3 atomer där två är av samma atomslag och 1 ska placerad i mitten. Varför sitter rvissa av de då i vinklade strukturer?
2. För att en atom ska vara dipol måste positivt och negativt centra för laddningar vara placerat på olika platser. Om vi tar en vattenmolekyl som exempel: Dess positiva laddningar är fördelade hos respektive väteatom, negativt centra hos syreatomen. Men centrum för positiva laddningar är ändå I mitten, mellan väteatomerna och sålunda i linje med syresättning negativa sida. Ändå klassar man den som dipol. Varför det?
Jag är inte riktigt säker på om jag förstår någon av din frågor fullt ut, men jag kan försöka besvara dem eftersom ingen annan har svarat ännu:
1)
Om du kollar på hybridisering får du svaret ganska fort. Åtminstone för organiska och vissa icke-organiska föreningar kan du kolla på något som kallas för "steric number". Det kan du använda för att ta fram bindningsvinkel. sp3-hybridisering motsvarar 109.5 grader, sp2 motsvarar 120 grader och sp motsvarar 180 grader. För andra typer av hybridisering (t.ex. spd) vet jag inte vinklarna.
2)
I vatten talar man om att syreatomen får en delvis negativ laddning eftersom den är väldigt elektronegativ jämfört med väte. Det betyder att elektronerna oftare befinner sig närmare syret än väteatomerna än om bindningen hade varit opolär. Detta betecknas med stora delta:
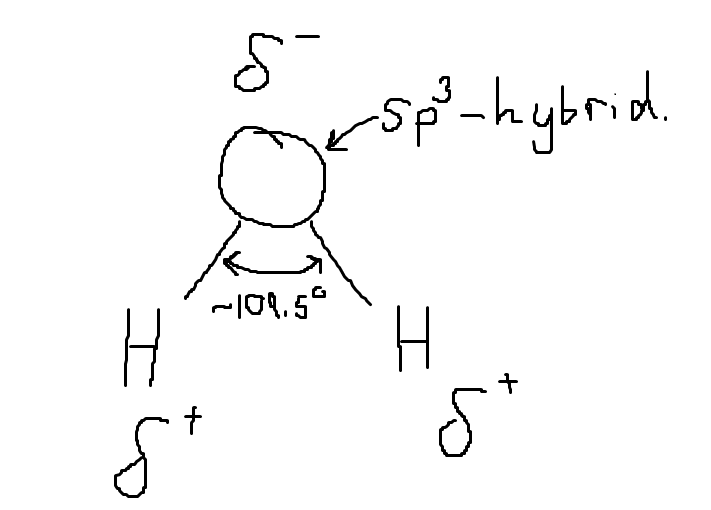
Experimentellt har man bestämt att bindningsvinkeln i vatten ligger närmare 105 grader, teorin motsvarar ju inte alltid perfekt verkligheten.
Tillägg: 6 dec 2023 10:21
Jag tror att allt bör stämma, men detta är ganska gammal kunskap för mig (var typ 1 och ett halvt år sedan jag hade detta i skolan) så om någon ser något fel får han gärna rätta det!
Gloson1 skrev:Hejsan. Jag har två frågor: Jag vet till stor del hur man målar upp en strukturformel, det jag dock är osäker på är hur man kan veta i vilken "formation" som atomerna sitter i, ex vinklad eller rak. Jag har hört att de olika elektronparen vill hamna i en så stor vinkel bort från varandra som möjligt, men denna vinkel borde väl nästan alltid vara som störst i en rak form om vi har ämnen med 3 atomer där två är av samma atomslag och 1 ska placerad i mitten. Varför sitter rvissa av de då i vinklade strukturer?
Man måste ta hänsyn till fria elektronpar också! Det gör att metan, ammoniak och vatten är tetraedrar allihop, fast ett hörn på ammoniakmolekylen och två hörn på vattenmolekylen är fria elektronpar, så de syns inte - och därmed är ammoniakmolekylen en tretalig pyramid och vattenmolekylen är vinklad.
2. För att en atom ska vara dipol måste positivt och negativt centra för laddningar vara placerat på olika platser. Om vi tar en vattenmolekyl som exempel: Dess positiva laddningar är fördelade hos respektive väteatom, negativt centra hos syreatomen. Men centrum för positiva laddningar är ändå I mitten, mellan väteatomerna och sålunda i linje med syresättning negativa sida. Ändå klassar man den som dipol. Varför det?
Ja, man kan säga att laddningarnas tyngdpunkter ligger på en linje, men de sammanfaller inte - den negativa laddningens tyngdpunkt är nära syreatomen, och den positiva laddningens tyngdpunkt är mellan väteatomerna - alltså inte på samma ställe, så vattenmolekylen är en dipol.
Hej igen. Menar du att syret i vattnet egentligen har ett elektronpar, men att detta egentligen inte är synligt?
En syreatom har 6 elektroner i sitt yttersta skal, och en väteatom har en elekton i sitt enda skal. Det betyder att syreatomen i en vattenmolekyl är omgiven av 6+1+1 = 8 elektroner, d v s 4 elektronpar (två elektronpar som bildar bindningar till var sin väteatom och två fria elektronpar). Dessa "vill" vara så långt från varandra som möjligt, d v s de pekar mot hörnen i en tetraeder.



