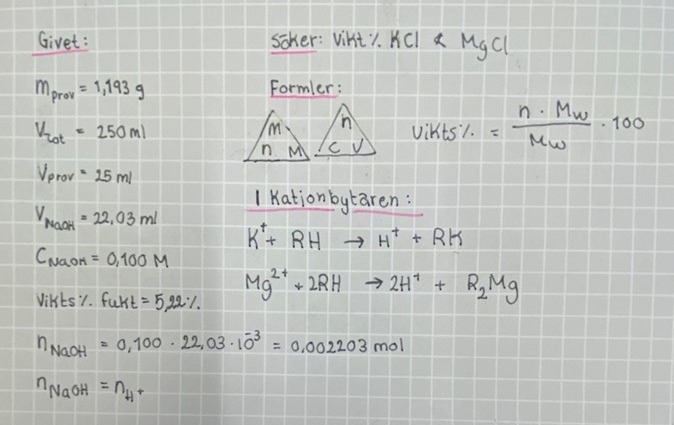Stökiometri
Hej! Har fastnat på den här frågan och vet verkligen inte hur jag ska gå till väga. Så här lyder frågan: Ett fast prov innehåller okända mängder kalium- och magnesiumklorid samt fukt. 1,193 g av
provet löses i vatten och lösningen späds till 250,00 mL. 25,0 mL av provet tillåts passera en
H+-mättad katjonbytare, och eluatet förbrukar 22,03 mL av en 0,100 M NaOH lösning.
Fukthalten i provet bestämdes till 5,22 vikts-%. Beräkna vikts-% av kalium- och
magnesiumklorid i provet.
Här är min lösning hittills:

alkemistenx skrev:Hej! Har fastnat på den här frågan och vet verkligen inte hur jag ska gå till väga. Så här lyder frågan: Ett fast prov innehåller okända mängder kalium- och magnesiumklorid samt fukt. 1,193 g av
provet löses i vatten och lösningen späds till 250,00 mL. 25,0 mL av provet tillåts passera en
H+-mättad katjonbytare, och eluatet förbrukar 22,03 mL av en 0,100 M NaOH lösning.
Fukthalten i provet bestämdes till 5,22 vikts-%. Beräkna vikts-% av kalium- och
magnesiumklorid i provet.Här är min lösning hittills:
Det mesta ser relevant ut, men jag förstår inte din formel för vikts-%. Så som du har skrivit den borde man kunna förkorta bort Mw(vad det nu betyder) och bara få fram att vikts-% är 100 ggr en substansmängd (vilken)?
jag skulle börja med ...
... att beräkna hur många gram torrt salt det fanns i 1,193 g av det fasta (men lite fuktiga) provet.
tar jag då 1,193 * 0,0522 = 0,0622746 g fuktigt salt och då 1,307 g torrt salt?
alkemistenx skrev:tar jag då 1,193 * 0,0522 = 0,0622746 g fuktigt salt och då 1,307 g torrt salt?
Nja, det torra saltet plus vattnet (= fukt) väger 1,193 g sammanlagt.
Om vi säger att provet innehåller x mol kaliumjoner och y mol magnesiumjoner, kan du då ställa upp de samband som behövs för att beräkna x och y?
Smaragdalena skrev:alkemistenx skrev:tar jag då 1,193 * 0,0522 = 0,0622746 g fuktigt salt och då 1,307 g torrt salt?
Nja, det torra saltet plus vattnet (= fukt) väger 1,193 g sammanlagt.
Om vi säger att provet innehåller x mol kaliumjoner och y mol magnesiumjoner, kan du då ställa upp de samband som behövs för att beräkna x och y?
jaså nej förlåt jag förstår verkligen inte vad eller hur jag ska göra
Hur många mol oxoniumjoner fanns det i provet som fått gå genom katjonbytaren?
Smaragdalena skrev:Hur många mol oxoniumjoner fanns det i provet som fått gå genom katjonbytaren?
Jag har gjort så här nu men det här blir jättefel. Det kan väll inte vara så mycket MgCl2 i 25 ml prov? Förstår inte hur man ska tänka. Det är 0,02203 mol oxoniumjoner i provet som fått gå igenom katjonbytaren. Detta innebär väll att det är samma mol hydroniumjoner som finns i prover eftersom molförhållandet mellan dom är 1/1???? Då borde man väll kunna få ut Mg2+ och k+ genom att använda hydroniumjonerna?

Det är svårt att hänga med i vad du skriver, du skriver för lite förklarande text. Substansmängden vätejoner är inte lika med substansmängden kaliumjoner eller dubbla substansmängden av magnesiumjoner, utan lika med SOMMAN av substansmängden kaliumjoner och dubbla substansmängden magnesiumjoner. Detta gör att du har fått ett orimligt högt värde - bra att du märkte att det var konstigt!
Du har 1,193 g fuktigt salt men fukthalten 5,22 vikts-%. Det betyder att massan torrt salt är 0,9478.1,139 g = 1,131 g torrt salt. Om vi har k kol kaliumklorid och m mol magnesiumklorid så vet vi att k.MKCl+m.MMgCl2 = 1,131 g.
1/10 av saltet får passera genom en katjonbytare, och eluatet neutraliseras av 22,03 ml NaOH-lösning med koncentrationen 0,100 mol/dm3. Det betyder att det fanns 0,02203.0.100.10 mol positiva laddningar i hela provet, d v s 0,02203 mol. Det betyder att k+2m = 0,02203 mol.
Nu har vi två obekanta och två ekvationer, så det är ett ekvationssystem som kan lösas.