Stämmer mina svar om denna reaktionsmekanism?
Halloj!
Jag sitter med a-,b- och c-frågan nedan:

Angående a) så tänker jag att produkten borde se ut så här:

Och den borde heta (R)-2-cyanopentan.
b)
Jag tänker att detta borde vara en SN2-reaktion eftersom det sker 100 % inversion av det stereogena centrat. Detta innebär att reaktionshastigheten är proportionell mot , så om man dubblar en av koncentrationerna, fördubblar man hela reaktionshastigheten. På samma sätt fyrdubblas reaktionshastigheten om koncentrationerna av båda reaktanterna dubbleras.
c)
Jag tänker att övergångstillståndet borde vara sådant att det kirala kolet får en sp2-hybridisering istället för en sp3-hybridisering och har delvisa bindningar till både den lämnande gruppen och nukleofilen:

Anledningen till att vi har 100 % inversion av det stereogena centrat är att cyanidjonen bara kan attackera "bakifrån". Attacken kan inte komma från hållet där bromiden sitter eftersom den skulle blockera attacken.
a) Medhåll.
b) Håller med här också. (Dock får jag alltid lite matematisk panik av den väldigt märkliga men ack så vanliga användningen av "fyrdubblas" i betydelsen "fyrfaldigas" 😵💫)
(c) I princip håller jag med om din förklaring. Om ni har gått igenom det skulle man kanske också kunna säga något om att HOMO (sp-orbital på cyanidkolet) och LUMO (sigma*-orbital för C-Br-bindningen) behöver överlappa med varandra för att reaktionen ska ske, vilket kräver att cyaniden attackerar från motsatt håll från bromet.
När det gäller övergångstillståndet tycker jag din skiss är lite m svårtolkad. Det vore bra om du kunde vara mer precis med hur du föreställer dig att vinklarna mellan de olika bindningarna är. Dock så förstår man vad du menar eftersom du skriver att kolet är sp2-hybridiserat i övergångstillståndet.
(Dock får jag alltid lite matematisk panik av den väldigt märkliga men ack så vanliga användningen av "fyrdubblas" i betydelsen "fyrfaldigas" 😵💫)
Haha jag tänkte faktiskt på exakt samma sak och var tvungen att slå upp "fyrdubbla" på svenska.se för att säkerställa att jag använde det rätt. Det låter ju som om man dubblerar något fyra gånger, alltså "sextonfaldigar".
(c) I princip håller jag med om din förklaring. Om ni har gått igenom det skulle man kanske också kunna säga något om att HOMO (sp-orbital på cyanidkolet) och LUMO (sigma*-orbital för C-Br-bindningen) behöver överlappa med varandra för att reaktionen ska ske, vilket kräver att cyaniden attackerar från motsatt håll från bromet.
Ja, vi har faktiskt pratat om HOMO-LUMO interaktioner tidigare! Men jag avstod från ett sådant resonemang eftersom jag inte visste vilka molekylorbitaler som deltog i interaktionen. Hur visste du t.ex. att LUMO blir en sigma*-orbital?
När det gäller övergångstillståndet tycker jag din skiss är lite m svårtolkad. Det vore bra om du kunde vara mer precis med hur du föreställer dig att vinklarna mellan de olika bindningarna är. Dock så förstår man vad du menar eftersom du skriver att kolet är sp2-hybridiserat i övergångstillståndet.
Ja, det var mina konstnärliga förmågor som var lite begränsande där. Jag ska försöka göra en bättre skiss:

EDIT: problemet i denna skiss är ju att det inte blir en plantrigonal struktur här. Samtidigt vet jag inte hur jag ska bestämma S/R på intermediären utan att någon bidning pekar in.
Naytte skrev:
Hur visste du t.ex. att LUMO blir en sigma*-orbital?
Man får göra en lista över vilka orbitaler som är i spel, och resonera över hur de borde ligga i energi. I det här fallet tror jag inte det finns några rimliga motkandidater, eftersom de andra bindningarna borde ha rätt höga sigma*-orbitaler, och de tomma atomorbitalerna på de andra atomerna borde också ligga betydligt högre.
På den här Libretext-sidan(läs gärna hela!) ritar de ut orbitalerna för CH3Br så här:
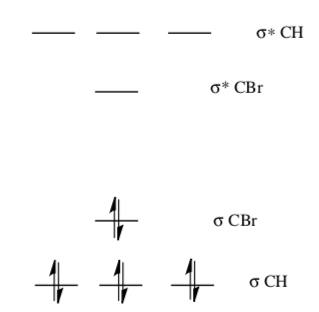
vilket känns ungefär rimligt. Jag skulle gissa att sigma/sigma*-orbitalerna för C-C-bindningarna ligger ungefär som de för C-H-bindningarna. Någonstans lite längre upp skulle jag gissa att de tomma L-skals-orbitalerna för väte ligger, och någonstans mitt i figuren borde de fulla sp3-orbitalerna med de fria elektronparen för brom också ligga. Men vill man vara mer säker måste man göra datorberäkningar eller experiment så klart.
Men sen vet vi ju också redan från uppgiftstexten (och kemisk allmänbildning) att det faktiskt sker en SN2-reaktion där C-Br-bindningen, vilket ju ger ett slags empiriskt belägg för att sigma*-orbitalen för den bindningen är LUMO.
Problemet i denna skiss är ju att det inte blir en plantrigonal struktur här.
Exakt. Jag tycker du borde rita så att det blir tydligt att strukturen är plantriagonal.
Samtidigt vet jag inte hur jag ska bestämma S/R på intermediären utan att någon bidning pekar in.
Jag hänger inte riktigt med här. Dels blandar du nog ihop intermediär och övergångstillstånd, och dels så tror jag inte det är tänkt att du ska försöka namnge övergångstillståndet eller beteckna det med R/S.
Jag hänger inte riktigt med här. Dels blandar du nog ihop intermediär och övergångstillstånd, och dels så tror jag inte det är tänkt att du ska försöka namnge övergångstillståndet eller beteckna det med R/S.
Jag uttryckte mig nog dåligt. Det jag menar är att övergångstillståndet ska ha samma stereokemi som substratet innan attacken.
Jag tittade på en video där det beskrevs att man skulle rita övergångstillståndet så att övergångstillståndet "behåller" sin stereokemi. Vid 02:08 beskrivs detta:
https://youtu.be/IRjOT1iE-zw?si=02H_KH0gSjHY3QfC&t=128
Jag har problem med att översätta det han gör med sitt övergångstillstånd till vårt fall här.
Jag tycker han krånglar till det lite. Jag tycker man kommer väldigt långt med att lugnt och metodiskt rita upp strukturen och steg för steg manipulera den i huvudet och på pappret. Vid behov kan man med fördel ta hjälp av en byggsats så att man får en klar och tydlig känsla för hur detta ser ut i 3D.
Så här hade jag ritat:

Jag blir fundersam kring den första ekvivalensen du ritar upp. Hur har du roterat molekylen? Har du roterat den runt pentankedjan så att metylgruppen pekar ut ur planet? Borde inte R-gruppen också peka ut ur planet då?
Nu tror jag att jag förstår.
Först har du roterat den runt pentankedjan, och sedan roterat den åt vänster? Så att det första kolet i etylgruppen ligger i planet?
Jag tänker mig att jag bara har roterat lite på C-pentyl-bindningen, så att C-Br-bindningen hamnar i planet, medan kolatomerna i pentylkedjan förblir fixerade i planet.
(Men ja, det var förvirrande av mig att både rotera och införa R-notationen i ett och samma steg.)
Ja okej, har vi fri rotation runt bindningen pga sp3-bindningen?
Exakt!
Om du har en modellsats (väldigt bra investering om man ska läsa mer organkemi!) så är det väldigt rekommenderat att bygga den här molekeylen och jämföra med figurerna.
Så om man roterar C-pentyl-bindningen, roterar man då i princip kolet på vilken bromen sitter?
Så kan man nog uttrycka det ja!
Jag känner att jag inte riktigt har terminologin för att beskriva de här operationerna. "Vrida"är kanske ett bättre ord än rotera? Någon som kan mer kemi (eller typ mekanik?) får gärna korrigera oss!
Men det låter som att du tänker rätt i alla fall!
För övrigt hade det kanske varit mer pedagogiskt att rotera hela den första strukturen efter övergångstillståndet lite grann, så att C-CN-bindningen hade varit vertikal, så att det blir tydligare hur den hänger ihop med övergångstillståndet.
Typ så här:
Vill bara säga att du hade rätt och att det var väldigt mycket lättare när man har en molekylbyggsats parat:


(ignorera allt damm)
Extremt användbart hjälpmedel! (Och lite kul att byggsatserna ser likadana ut nu som för 15 år sedan när jag skaffade min! 😁 )



