Stämde min tankegång?
Jag hade nyligen ett prov på området syra-baser, och på en fråga skulle man avgöra vilka av ett antal baser som var starkast. Alla baser bestod av en identisk karboxylgrupp ihopsatt med en kol, på vilken det satt olika saker på varje bas:
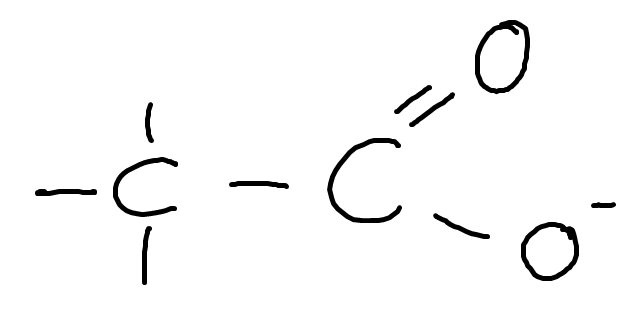
Mitt grundläggande resonamng var att en större induktiv effekt på den vänstra kolen bör göra basen svagare. Stämmer detta? Jag tänkte att ju mindre den induktiva effekten är, desto starkare blir den möjliga OH-bindningen på karboxylgruppen, vilket skulle göra den möjliga syran mindre benägen att protolysera.
Induktiv effekt är rätt, men hur menar du med "större" effekt? Man brukar prata om positiv och negativ induktiv effekt, där alkylgrupper (kolvätekedjor) ger en positiv induktiv effekt medan elektronegativa atomer ger en negativ effekt.
När det gäller karboxylsyror så förstärks syraegenskaperna av grupper som ger negativ induktiv effekt. Som exempel kan nämnas att triklorättiksyra är en betydligt starkare syra (pKa = 0,66) än vanlig ättiksyra (pKa = 4,76). Syraaegenskaperna blir istället svagare av större alkylgrupper vilka ger en positiv induktiv effekt. Det ser man tydligt om man jämför pKa för myrsyra, ättiksyra, propionsyra, smörsyra o.s.v. där pKa blir successivt högre i takt med att kolkedjan blir längre.
Sen gäller som vanligt att en starkare syra har en svagare korresponderande bas, så triklorättiksyras korresponderande bas är mycket svagare än ättiksyras motsvarighet. Butansyrans korresponderande bas är starkare än myrsyrans motsvarighet.
Det jag menar med större och mindre effekt är att atomerna bundna till den vänstra kolen är mer eller mindre elektronnegativa. Exempelvis skulle basen antagligen vara svagare ifall det satt tre klor bundna till kolen istället för två barium och en väte. Så jag menade nog negativ induktiv effekt då.



