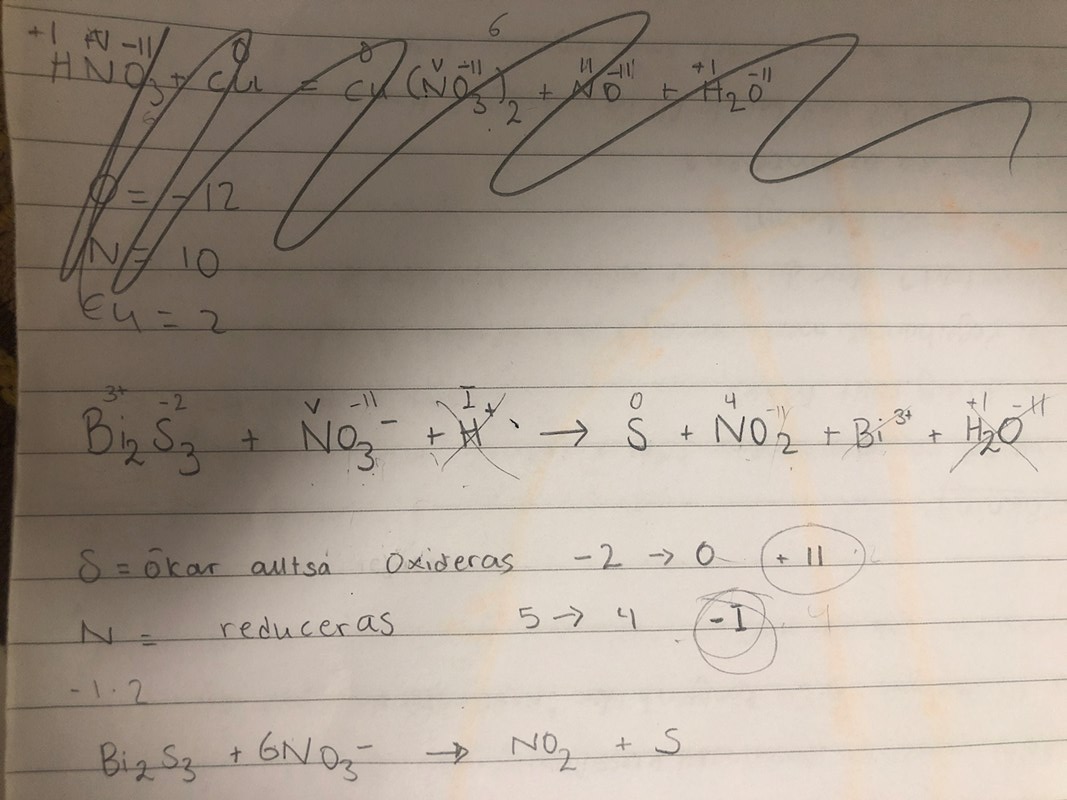Redox
 Har testat med dena frågan jätte länge men kommer inte fram till vad jag ska göra det som jag har gjort hittils är bara att skriva allas OT men vet inte hur jag ska fortsätta
Har testat med dena frågan jätte länge men kommer inte fram till vad jag ska göra det som jag har gjort hittils är bara att skriva allas OT men vet inte hur jag ska fortsätta 
Roro2000 skrev:
Har testat med dena frågan jätte länge men kommer inte fram till vad jag ska göra det som jag har gjort hittils är bara att skriva allas OT men vet inte hur jag ska fortsätta
Du har kommit en bra bit på vänstersidan, du har balanserat antalet svavel och kväve, men det måste vara lagom många på högersidan också! Vad finns det mer för reaktanter (när man är i sur lösning)? Vilket mer ämne bildas (det står i uppgiften)?
Saken är att jag vet inte varför det blir en 6 stycken Kväve och endast 1 svavel. Det var det som stod i facit men det som jag vet hur man gör är endast att sätta ut oxidationstalen och efter det vet jag inte vad man ska göra. Menar du saltpetersyra
I varje Bi2S3 finns det 3 svavel. Varje svavel oxideras två steg, så det blir 6 steg för varje Bi2S3. Det bildas tre svavelatomer från varje Bi2S3. Varje nitratjon reduceras ett steg, så det behövs 6 nitratjoner för att reduceras 6 steg.
Salpetersyra är en stark syra, så det finns inga salpetersyramolekyler i salpetersyra, bara oxoniumjoner och nitratjoner.
Vad menar du med att den oxideras i två steg
Inte oxideras i två steg, utan oxideras två steg, från OT = -II till OT = 0.
Tack så jätte mycket för hjälpen :)