Reaktionsmekanism bilda peptidbindning
Hej!
Jag har några funderingar angående reaktionsmekanismen när två aminosyror bildar en peptidbindning. Jag har försökt rita upp reaktionsmekanismen och jag undrar bara om det ser bra ut eller om det är något jag har missat och om min förklaring stämmer.
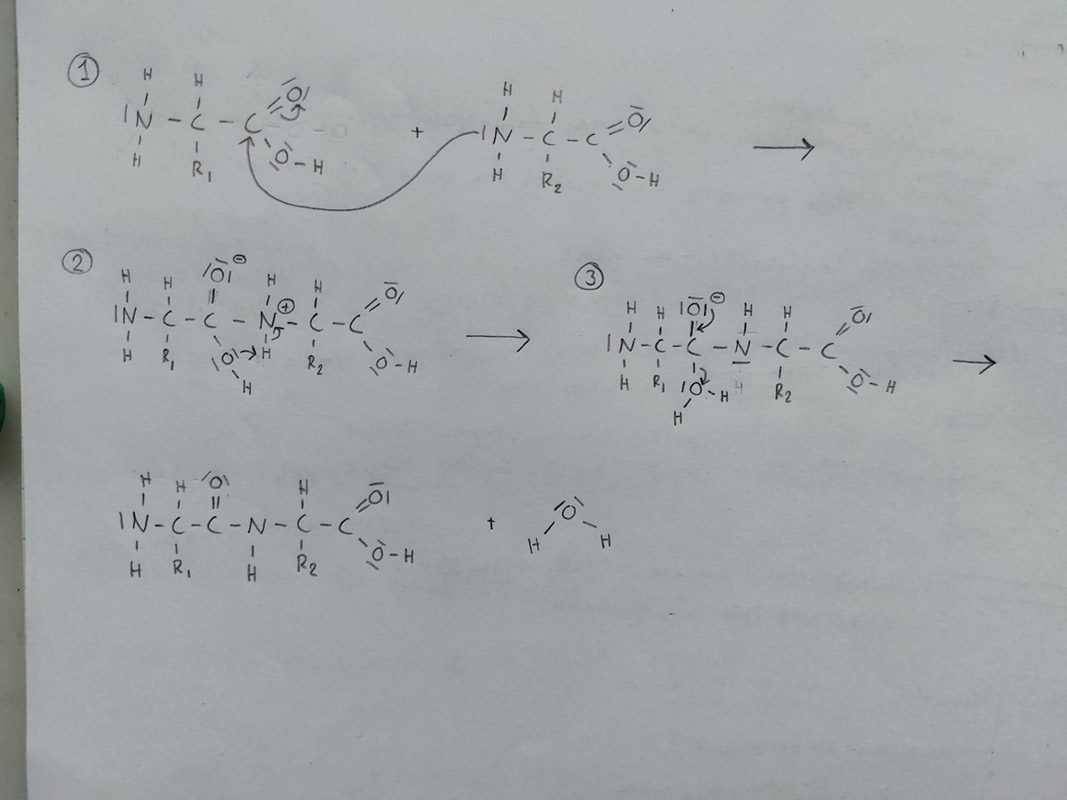
1. Det fria elektronparet på kväveatomen attackerar kolatomen i karboxylgruppen genom en nukleofil attack. Kolatomen är svagt positivt laddad eftersom den är bunden till två syreatomer med högre elektronegativitetsvärde. Kolatomen binder nu för många bindningar och det dubbelbundna syret drar till sig den en bindningen i dubbelbindningen.
2. Den positivt laddade kväveatomen som är starkt elektronegativ drar till sig bindningselektronerna till väteatomen samtidigt som syreatomen i OH-gruppen attraherar samma väteatom.
3. Syreatomen i tidigare OH-gruppen drar till sig bindningselektronerna till kolatomen och blir en fri vattenmolekyl. Negativa laddningen på syreatomen försvinner genom att en dubbelbindning till kolatomen bildas.
Tack på förhand!
linsun06 skrev:Hej!
Jag har några funderingar angående reaktionsmekanismen när två aminosyror bildar en peptidbindning. Jag har försökt rita upp reaktionsmekanismen och jag undrar bara om det ser bra ut eller om det är något jag har missat och om min förklaring stämmer.
Din ritade mekanism ser bra ut.
1. Det fria elektronparet på kväveatomen attackerar kolatomen i karboxylgruppen genom en nukleofil attack. Kolatomen är svagt positivt laddad eftersom den är bunden till två syreatomer med högre elektronegativitetsvärde. Kolatomen binder nu för många bindningar och det dubbelbundna syret drar till sig den en bindningen i dubbelbindningen.
Ett par av elektronerna ifrån dubbelbindningen omlagras till syret, men man brukar beskriva att detta sker samtidigt som den nya bindningen (mellan N-C) bildas - på så vis har kolet fyra bindningar som mest.
2. Den positivt laddade kväveatomen som är starkt elektronegativ drar till sig bindningselektronerna till väteatomen samtidigt som syreatomen i OH-gruppen attraherar samma väteatom.
I och med att kvävet skapar en till bindning, får det den extra positiva laddningen - och detta gör vätet mycket surare. Som jämförelse har ammoniak (som liknar den fria aminosyrans aminogrupp) ett pKa på ca 32 och ammoniumjonen (som liknar det du ritat i vid tvåan) ett pKa på ca 9.
Övergripande stämmer det att vätet som fanns på aminosyrans aminogrupp tas över av detta syre, så att det senare kan lämna som vatten. Men oftast sker dessa reaktioner i vatten, och då kan en eller flera vattenmolekyl(er) hjälpa till att överföra protonen till hydroxigruppen.
3. Syreatomen i tidigare OH-gruppen drar till sig bindningselektronerna till kolatomen och blir en fri vattenmolekyl. Negativa laddningen på syreatomen försvinner genom att en dubbelbindning till kolatomen bildas.
Nästan mer tvärt om i ordningen. När ett av de tre fria elektronparen på det negativt laddade syret börjar återbilda dubbelbindningen till kolet, kommer enkelbindningen till det andra syret försvagas. Och till slut kommer dubbelbindningen finnas men ingen enkelbindning, utan en fri vattenmolekyl. Detta steg brukar också beskrivas som att bindningarna bildas/bryts samtidigt, och övergår från enkel+enkel till dubbel. Alternativ kan man beskriva det som att det "extra" elektronparet på syret hoppar ner mot kolet igen, och då sparkar ut elektronerna i C-O bindningen, som då hamnar hos den lämnande vattenmolekylen.
Tack på förhand!
Tack så jättemycket för den utförliga förklaringen!
För all del, kul att det hjälpte!

