Reaktionshastighet
Hejsan, jag har problem att lösa uppgfit b vill förstå hur reaktionshastigheten räknas ut men lyckas inte.
Uppgift 2:17 - Kemiboken 2
b) 0sek = 80 mmol/dm^3
150 s= 15mmol/dm^3
(80-15 mmol/dm^3) / (150s) = 0,43 mmol/dm^3 * s^-1
Men facit säger: ca 0,05 mmol/dm^3 / s
- Jag antar att det är enheterna jag strular till här men vet inte vart eller hur jag ska omvandla, har aldrig använt mmol/dm^3 från Kemi 1 utan bara mol/dm^3 och sedan förvirrar enheten i facit mig, mmol/dm^3 /s, ska det inte vara mmol/dm^3 * s^-1?
Tack på förhand för hjälp!
Hej och välkommen till Pluggakuten!
Skulle du kunna ladda upp en bättre bild, så vi kan se x-axeln i diagrammet.
sictransit skrev:Hej och välkommen till Pluggakuten!
Skulle du kunna ladda upp en bättre bild, så vi kan se x-axeln i diagrammet.
Tack så mycket!
Absolut här kommer en bättre bild:
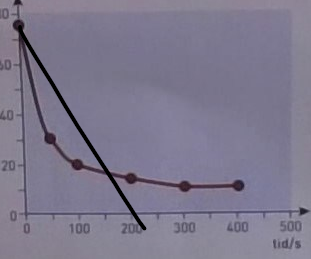
Du kan inte använda datapunkten vid för att uppskatta reaktionshastigheten vid . Din "tangent" (snarare en sekant) skulle se ut så ungefär här:
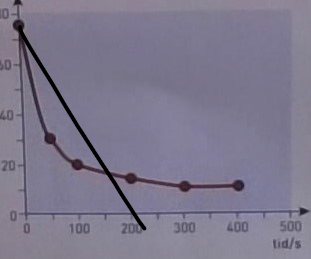
Lutningen på den svarta linjen jag drog in är verkligen inte samma som lutningen i punkten vid . Du borde använda en annan datapunkt, förslagsvis . Då får du uppsakttningen:
naytte skrev:Du kan inte använda datapunkten vid för att uppskatta reaktionshastigheten vid . Din "tangent" (snarare en sekant) skulle se ut så ungefär här:
Lutningen på den svarta linjen jag drog in är verkligen inte samma som lutningen i punkten vid . Du borde använda en annan datapunkt, förslagsvis . Då får du uppsakttningen:
Okej jag förstår tänket, men om jag då tar tex t=50 så blir det ju fel, förstår inte riktigt hur jag ska tänka:
17.5 - 30 mmol/dm^3 / 150-50 = -0.125 mmol/dm^3 * s^-1?
Enheterna här är också förvirrande, mmol/dm^3/s har inte ens nämnts under kapitlet..
Är du med på att lutningen i punkten ger reaktionshastigheten för reaktionen då 150 sekunder har gått?
Enheterna här är också förvirrande, mmol/dm^3/s har inte ens nämnts under kapitlet..
Att enheten för koncentration är mol/dm3 borde du ha med dig från Ke1. I det här fallet är koncentrationerna så låga att det blir bekvämare siffror om man räknar i mmol i stället för mol - visst är det mer bekvämt med 400 mmol/dm3 jämfört med 0,400 mol/dm3?
naytte skrev:Är du med på att lutningen i punkten ger reaktionshastigheten för reaktionen då 150 sekunder har gått?
Jajemen det är jag med på, men hur ska jag veta vilken annan datapunkt jag ska använda?
Smaragdalena skrev:Enheterna här är också förvirrande, mmol/dm^3/s har inte ens nämnts under kapitlet..
Att enheten för koncentration är mol/dm3 borde du ha med dig från Ke1. I det här fallet är koncentrationerna så låga att det blir bekvämare siffror om man räknar i mmol i stället för mol - visst är det mer bekvämt med 400 mmol/dm3 jämfört med 0,400 mol/dm3?
Ja mol/dm^3 har jag med mig från kemi 1, men aldrig jobbat med mmol/dm^3 och blev därför osäker på omvanligen till mol/dm^3.
/s och s-1 är samma sak, "per sekund".
Laguna skrev:/s och s-1 är samma sak, "per sekund".
Ursäkta läste fel och såg "inte samma sak", okej tack för hjälpen!
Pomperipossa skrev:naytte skrev:Är du med på att lutningen i punkten ger reaktionshastigheten för reaktionen då 150 sekunder har gått?
Jajemen det är jag med på, men hur ska jag veta vilken annan datapunkt jag ska använda?
Uppenbarligen kan vi ju inte exakt räkna ut lutningen i den punkten, eftersom vi inte känner till kurvan. Vi måste alltså på något sätt dra en linje som har en liknande lutning jämfört med tangenten. Då väljer vi helt enkelt en annan datapunkt, så att linjen som dras mellan denna och får nästan samma lutning som tangenten skulle ha haft.
Hänger du med?
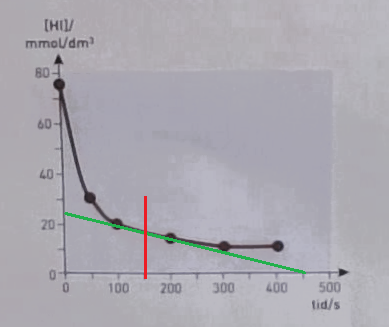
Vi vill veta lutningen på kurvan i (röda) punkten t = 150s.
Jag drar en (grön) linje som tangerar kurvan så gott det går i den punkten.
Sedan behöver jag hitta två ställen där det är lätt att läsa av x/y-värden.
Jag tycker mig se att linjen skär x-axeln vid t=450 s. Där har jag en punkt: (450;0)
Sedan skär linjen y-axeln vid 25 mmol/dm3. Nu har jag min andra punkt: (0,25)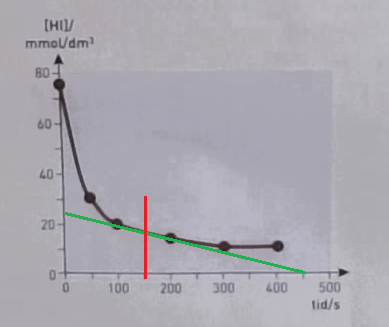
Lutningen k får jag av:
Det är ett negativt värde eftersom koncentrationen minskar.
sictransit skrev:Vi vill veta lutningen på kurvan i (röda) punkten t = 150s.
Jag drar en (grön) linje som tangerar kurvan så gott det går i den punkten.
Sedan behöver jag hitta två ställen där det är lätt att läsa av x/y-värden.
Jag tycker mig se att linjen skär x-axeln vid t=450 s. Där har jag en punkt: (450;0)
Sedan skär linjen y-axeln vid 25 mmol/dm3. Nu har jag min andra punkt: (0,25)
Lutningen k får jag av:
Det är ett negativt värde eftersom koncentrationen minskar.
Tack så mycket för förklaringen, det hjälpte massor!