reaktion oxred grundläggande information?
2 Mg + O2 --> 2 MgO
1. hur blir laddningen här? alltså 1 Mg har ju laddningen 2+ (blir det 4+ i detta fall då? eller räknas tvåan bort då)
och sen samma sak med syret, när man sätter ut ox-tal, räknar man för EN (-2) eller för två (O2) alltså (-4?)
mer allmän fråga....
räknar man för EN enstaka atom eller räknar man med koeffcient samt index tal i laddning?
2. syre har ox tal -2 (tot -4)
magnesium har ox tal +2 (tot +4)
sedan blir syre från -4 till 0, alltså avger den väl 4 elektroner och därmed är det den som oxideras?
men svaret är att den reduceras?
men om det är en reduktion så tar den väl upp elektroner, alltså går typ från -4 till -6?
skulle någon kunna klargöra detta för mig?
Magnesiumjonen har alltid laddningen +2. Att det bildas två MgO påverkar inte laddningen (eller oxidationstalen). Detsamma gäller syret.
Syre går från oxidationstalet 0 i syrgas till -II i magnesiumoxiden, så syre reduceras motsvarande två elektroner per atom (fyra elektroner per syrgasmolekyl).
Teraeagle skrev:Magnesiumjonen har alltid laddningen +2. Att det bildas två MgO påverkar inte laddningen (eller oxidationstalen). Detsamma gäller syret.
Syre går från oxidationstalet 0 i syrgas till -II i magnesiumoxiden, så syre reduceras motsvarande två elektroner per atom (fyra elektroner per syrgasmolekyl).
så man räknar alltså inte med koeffcienten framför eller index talen?
alltså i detta fallet blev laddningen på slutet -2 och inte -4 (syre har ot -2 men tänkte de blev -4 då det var 2 MgO, dvs 2*-2=-4)
alltså gick det från 0 till -2 = upptog elektroner = reduktion
Oxidationstalen beror inte av koefficienterna. Men om du har två syren som går från 0 till -II i oxidationstal så frigörs ju totalt fyra elektroner. Två per syreatom som ändrar oxidationstal.
Teraeagle skrev:Oxidationstalen beror inte av koefficienterna. Men om du har två syren som går från 0 till -II i oxidationstal så frigörs ju totalt fyra elektroner. Två per syreatom som ändrar oxidationstal.
jaha, men jag tänker när man ska balansera redoxreaktioner, ska man då skriva oxidationstalet för "enstaka" atom eller den totala? (alltså inkludera koeffcienterna)
Enstaka atomer.
Teraeagle skrev:Enstaka atomer.
index talen ska man väl ha med?
typ H2O
(då multiplicerar man in tvåan?)
Nja, i det där fallet har väte +I och syre -II.
Teraeagle skrev:Nja, i det där fallet har väte +I och syre -II.
ja, men den totala laddningen är väl 0
och eftersom väte har +1 och syre -2
så vet vi att väte blir +II pga det är två stycken
(och då tar de ut varandra)
eller?
Summan av väteatomernas oxidationstal blir +II, men varje väteatom har oxidationstalet +I. Om du ombeds sätta ut oxidationstalen ska du skriva +I, inte +II.
Teraeagle skrev:Summan av väteatomernas oxidationstal blir +II, men varje väteatom har oxidationstalet +I. Om du ombeds sätta ut oxidationstalen ska du skriva +I, inte +II.
tack snälla!
när brukar man använda sig utav elektronövergångsmetoden? alltså typ sånna formler
2 Mg --> 2 Mg2+ + 4 e-
alltså varför skulle man vilja redovisa oxidationen eller reduktionen själv såhär?
"Elektronövergångsmetoden" har jag aldrig hört*. Metoden där man skriver en oxidatation, en reduktion och lägger ihop dem till en totalreaktion brukar kallas delförloppsmetoden, eller halvcellsmetoden. På gymnasiet är den ganska ovanlig för att balansera redoxreaktioner, men på universitetet är den ganska vanlig. På gymnasiet dominerar oxidationstalsmetoden.
Delförloppsmetoden är särskilt användbar inom elektrokemi där man ska räkna ut normalpotentialer för en reaktion. Då kan man snabbt se vad den elektromotoriska spänningen blir för en galvanisk cell.
(*Men efter en googling så är det ett namn som vissa faktiskt använder för denna metod)
Teraeagle skrev:"Elektronövergångsmetoden" har jag aldrig hört*. Metoden där man skriver en oxidatation, en reduktion och lägger ihop dem till en totalreaktion brukar kallas delförloppsmetoden, eller halvcellsmetoden. På gymnasiet är den ganska ovanlig för att balansera redoxreaktioner, men på universitetet är den ganska vanlig. På gymnasiet dominerar oxidationstalsmetoden.
Delförloppsmetoden är särskilt användbar inom elektrokemi där man ska räkna ut normalpotentialer för en reaktion. Då kan man snabbt se vad den elektromotoriska spänningen blir för en galvanisk cell.
(*Men efter en googling så är det ett namn som vissa faktiskt använder för denna metod)
jaha okej (:
vill bara kolla så jag är på rätt spår..
om jag har
Cl2 + 2 Br- ---> Br2 + 2 Cl-
blir det väl
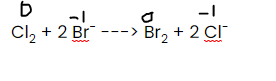
så klor går från 0 till -1 ----> reduktion
och brom går från -1 till 0 -----> oxidation
Ja det är rätt :)
Teraeagle skrev:Ja det är rätt :)
tack snälla för hjälpen!


