Potentiometrisk titrering
Hej,
Jag har en uppgift där jag har en enprotonig syra HA med två pKa-värden. Jag kommer då att behöva ställa upp ett pH-diagram med hjälp av rätt protonvillkor. Det första man gör är ju då att undersöka hur syran föreligger från början och syran borde ju då föreligga som en enprotonig syra då den bara har en proton att avge. Om vi har en enprotonig syra så borde vi ju bara få en ekvivalenspunkt i pH-diagrammet. Men då vi har två pKa-värden så får vi ju istället två ekvivalenspunkter och det är det jag inte fattar.
Hur kan en enprotonig syra få två pKa-värden och hur blir protonvillkoret?
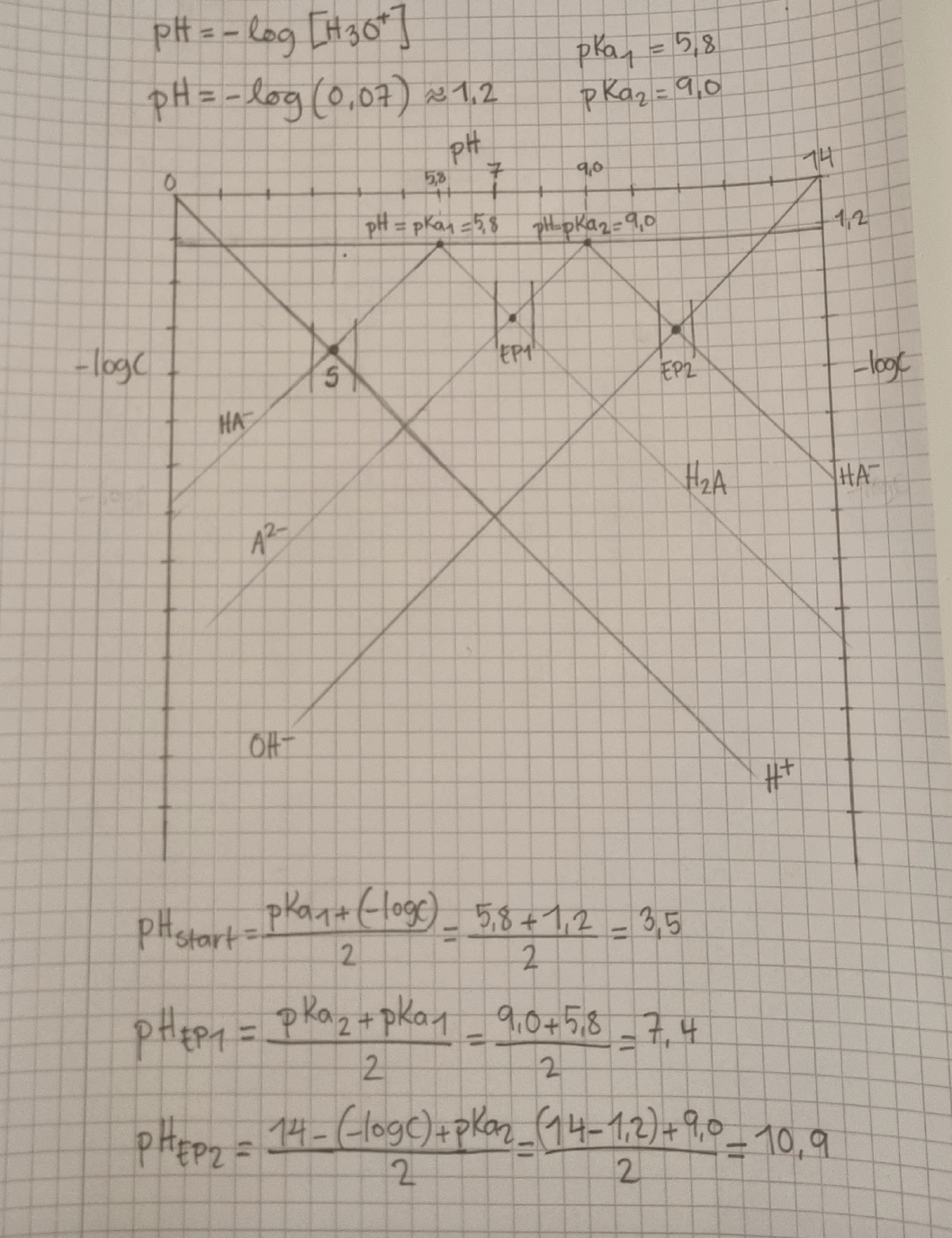
Sen så har jag testat att lösa uppgiften för när vi har två pKa-värden men undrar vart i beräkningarna jag gör fel? För det verkar som att startpunkten och ekvivalenspunkt 1 är fel utsatta i pH-diagrammet, men jag fattar inte vart i beräkningarna jag gör fel.
Skulle uppskatta om jag kunde få ett svar så fort som möjligt 😊
Hur vet du att syran är enprotonig?
Är det inte så att HA bara har en proton? Trodde att det var så eftersom att den bara har en vätejon
Skriver man "HA" brukar man mena en enprotonig syra, ja, men ditt diagram visar fördelningen av olika species i en lösning av den tvåprotoniga syran H2A. Det var därför jag funderade hur du vet att syran är enprotonig, för ditt diagram beskriver inte en enprotonig syra och en enprotonig syra har bara ett pKa-värde.
Ja, precis. Det kanske blir lite tydligare om jag skickar själva uppgiftsbeskrivningen. För det är det som jag också är förvirrad över. Vi har HA men två pKa-värden, vilket ger två ekvivalenspunkter.
Du har inte HA, utan NaHA. Det är natriumsaltet till den tvåprotoniga syran H2A.
Exempel: Om H2A är kolsyra (H2CO3) skulle NaHA motsvara saltet natiumvätekarbonat (NaHCO3).
Jaha, nu fattar jag! Men en annan fråga, jag har testat placera ut ekvivalenspunkterna utifrån protonvillkor enligt följande men läraren säger att startpunkten och EP1 är felplacerade.
Vart har jag tänkt fel?



Protonvillkoret säger att om en species avger en vätejon så måste den tas upp av någonting annat eller finnas som fri vätejon i lösningen. Om vatten genomgår autoprotolys så får man en fri vätejon (oxoniumjon om man ska vara petig) och en hydroxidjon. Om HA- jonen genomgår protolys måste det bildas en A2- jon och antingen en H+ jon eller en H2A molekyl. Så ditt protonvillkor borde egentligen se ut såhär:
| H+ | H2O | OH- |
| H2A | HA- |
A2- |
Vilket då ger att
[H+]+[H2A]=[OH-]+[A2-]
Ja och det har jag ju i protonvillkoret för EP1, eller?
Sen så bara för att se om jag hänger med, så du menar alltså att jag har en tvåprotonig syra eller?
Förstår inte helt vart i protonvillkoret jag har tänkt fel...
Om vi tänker oss igenom hur titrerkurvan ser ut vid titrering av H2A: I en lösning av ren H2A finns en jämvikt som innebär att [HA-]=[H+] om man bortser från vattens autoprotolys (rimligt). Detta motsvarar det du har markerat som startpunkt (S).
Sedan ska man igenom en halvtitrerpunkt där [H2A]=[HA-], vilket motsvarar den punkt där du har satt ut pKa 1.
Sedan ska vi komma till en ekvivalenspunkt där lösningen i princip bara består av [HA-], vilket motsvaras av den punkt du har märkt ut som EP1.
Sedan ska vi vidare till en ny halvtitrerpunkt där [HA-]=[A2-] vilket motsvarar den punkt du hat märkt ut med pKa 2.
Till sist ska vi till andra ekvivalenspunkten där lösningen i princip bara består av A2-, vilket stämmer med den punkt du har markerat som EP2.
Så i min värld ser det nog ut som att diagrammet är rätt ritat. Såvida jag inte missar någonting, vilket är fullt möjligt. Därför tolkar jag det som att du principiellt har gjort rätt men att du har gjort något annat fel. Det enda felet jag kan se är att du har fel lutning på A2- före första halvtitrerpunkten (lutningen ska vara dubbelt så brant). På motsvarande sätt ska lutningen vara dubbelt så brant för H2A efter andra halvtitrerpunkten.
Okej, så skulle du kunna illustrera på ett ungefär hur lutningen ska vara för A2-?
Sen så låter det som att det korrekta svaret är att syran alltså föreligger som en tvåprotonig syra, om jag har förstått rätt? Men läraren sa att det är fel, samtidigt som hon sa att det ska finnas två ekvivalenspunkter. Vad kan hon mena är fel tror du?
Diagrammet visar ett helt system, som man i detta fall skulle kunna kalla "H2A-systemet". Man pratar om sulfatsystemet, karbonatsystemet, fosfatsystemet osv. Diagrammet kan användas till alla species i detta system. I just ditt fall har du specien HA-, vilken ingår i det tvåprotoniga H2A-systemet, men som inte själv är en tvåprotonig syra.
Angående hur diagrammet ska se ut: Bildgoogla "logarithmic diagram of diprotic acid" så får du fram ett antal exempel.
Så ursäkta om jag upprepar men bara för att förtydliga; ska man svara att syran föreligger som HA-? För jag förstår resonemanget men inte helt vad man ska svara i slutet.
Sen så har jag alltså rätt protonvillkor, eller?
Ska pH-diagrammet se ut ungefär likt diagrammet nedan?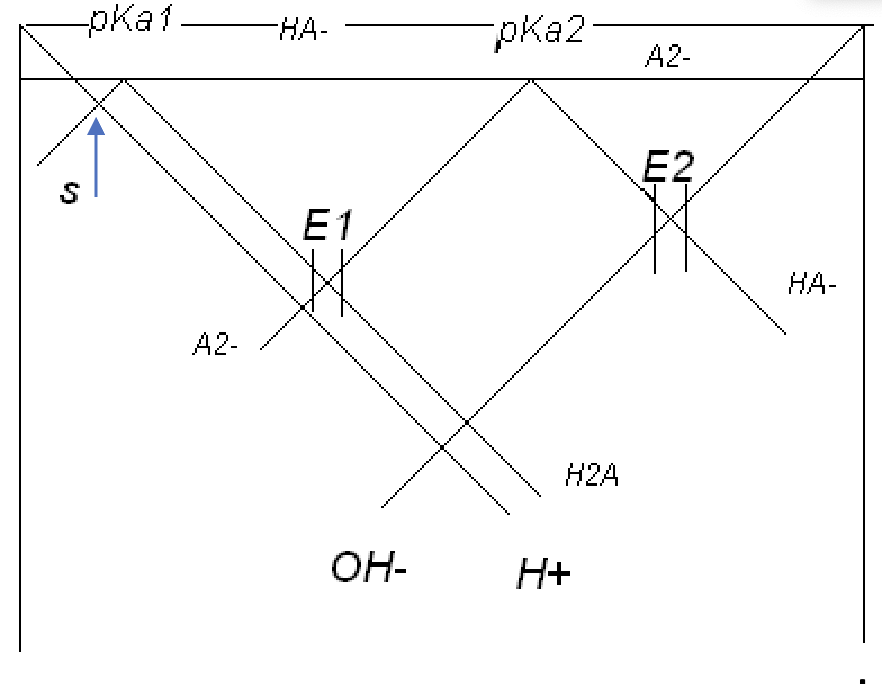
En annan sak som man frågar i uppgiften är om man ska titrera med en bas eller syra? Hur kan man ta reda på det?
Det finns ingen sådan fråga i uppgiften, så vad du menar med "syran föreligger som HA-" förstår jag inte. Du har en lösning av HA- joner, ja, om det är vad du syftar på.
Jag tycker att diagrammet ser rätt ut.
Ja, precis. Jag ser heller inget fel på diagrammet men som sagt så säger min lärare att startpunkten och EP1 är fel placerade.
Vet inte kan det vara fel på protonvillkoret? Kan det vara så att jag initialt ska börja från HA- och inte med H2A vid protonvillkoret för startpunkten?
Du får nog fråga läraren, om ingen annan här i forumet hittar något som jag har missat...
Men ser protonvillkoret rätt ut? För enligt min lärare så ska jag hitta och utgå från rätt protonvillkor för då menar hon att startpunkten och EP1 hamnar på andra ställen. Så det är därför jag misstänker lite att det kanske är något fel i protonvillkoret.
Jag vet att jag ska ha en startpunkt och två ekvivalenspunkter. Enligt läraren så är startpunkten och första ekvivalenspunkten felplacerade i pH-diagrammet och det beror på att jag har tagit fram fel protonvillkor.
Jag undrar om någon vet hur man ställer upp protonvillkor för NaHA och vart jag kan ha gjort fel?




