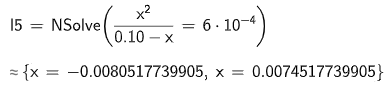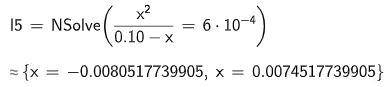pH av en diprotisk syralösning
Hej! Återigen till ett tema som min föreläsare missat, men rekommenderat uppgifter kring.
Jag har försökt läsa mig till och kollat på YouTube, men något verkar bli fel :(
"Calculate the pH of the diprotic solution of 0,10M (COOH)2 at ; ignorning the second deprotonation only when the approximation1 is justified:"
1: min bok skriver att om kan den andra deprotoneringen försummas.
Min lösning:
"the approximation" (se ovan) bör inte användas, min bok ger värdena
Jag försöker för det första komma fram till en att sätta upp själva deprotoneringsreaktionen. Det är säkert ännu en gymnasiegrej som jag glömt, men men.
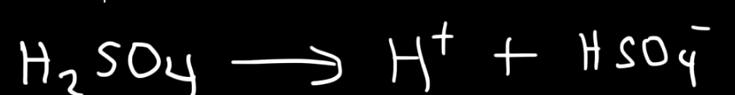
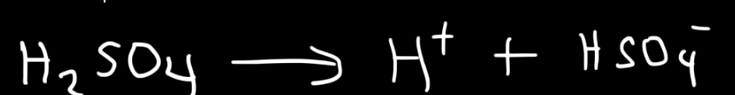
Jag höll tidigare på med ett exempel om H2SO4, där man skrev följande första reaktion
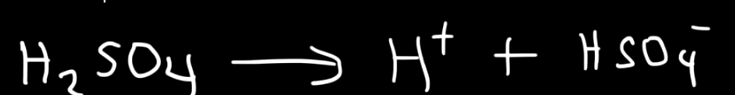
Så jag tänkte först att den första reaktionen för oxalsyran skulle vara:
(COOH)2 --> HCOO-+H+
Men enligt en numera ökad chattbot, ska reaktionera vara:

(dammar av fyra år gammal kunskap från distansundervisningstider, ni får ursäkta mig om jag inte minns det här!)
Men oavsett vem av oss man litar på, borde väl ICE-metodiken för första tabellen åtminstone bli samma princip:
Om vi säger att mitt förslag är rätt och sätter upp ICE:
| R | (COOH)2 | HCOO- | H+ | |
| I | 0,10 | |||
| C | -x | +x | +x | |
| E | 0,10-x | +x | +x |
ger mig isåfall första lösningen som jag kallar :
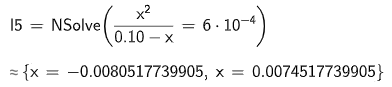
Reaktion 2, kommer den då bli:
HCOO- + H2O <-> COO-+H3O+?
Eller tänker jag fel?
Jag har svårt att ställa upp nästa reaktion med andra ord.
Sen får jag sätta upp en till ICE-tabell, inkludera ursprungliga koncentrationen av alla reaktanter från första reaktionen (koncentrationen är ), lösa ut koncentrationen av alla produkter i reaktion 2 och sedan använda för att få fram koncentrationen $$[H_3O+]. Låter det som en rimlig metod?
coffeshot skrev:Hej! Återigen till ett tema som min föreläsare missat, men rekommenderat uppgifter kring.
Jag har försökt läsa mig till och kollat på YouTube, men något verkar bli fel :(
"Calculate the pH of the diprotic solution of 0,10M (COOH)2 at ; ignorning the second deprotonation only when the approximation1 is justified:"
1: min bok skriver att om kan den andra deprotoneringen försummas.
Min lösning:
"the approximation" (se ovan) bör inte användas, min bok ger värdena
Jag försöker för det första komma fram till en att sätta upp själva deprotoneringsreaktionen. Det är säkert ännu en gymnasiegrej som jag glömt, men men.
Jag höll tidigare på med ett exempel om H2SO4, där man skrev följande första reaktion
Så jag tänkte först att den första reaktionen för oxalsyran skulle vara:
(COOH)2 --> HCOO-+H+
Men enligt en numera ökad chattbot, ska reaktionera vara:
(dammar av fyra år gammal kunskap från distansundervisningstider, ni får ursäkta mig om jag inte minns det här!)
Men oavsett vem av oss man litar på, borde väl ICE-metodiken för första tabellen åtminstone bli samma princip:
Om vi säger att mitt förslag är rätt och sätter upp ICE:
R (COOH)2 HCOO- H+ I 0,10 C -x +x +x E 0,10-x +x +x ger mig isåfall första lösningen som jag kallar :
Reaktion 2, kommer den då bli:
HCOO- + H2O <-> COO-+H3O+?
Eller tänker jag fel?
Jag har svårt att ställa upp nästa reaktion med andra ord.
Sen får jag sätta upp en till ICE-tabell, inkludera ursprungliga koncentrationen av alla reaktanter från första reaktionen (koncentrationen är ), lösa ut koncentrationen av alla produkter i reaktion 2 och sedan använda för att få fram koncentrationen $$[H_3O+]. Låter det som en rimlig metod?
Den här gången har faktiskt AI:n rätt. Det du har skrivit är en förenklad variant, men det finns inga fria vätejoner i en vattenlösning, de fastnar på vattenmolekyler så att det bildas oxoniumjoner.
Ditt uttryck för Ka1 ser bra ut. När jag läste kemi (förra årtusendet!) så skulle vi ha försummat x i nämnaren och då skulle man ha fått ekvationen x2 = 0,1.6.10-4 som man löser genom att dra roten ur båda led så att man får x = 0,00775 mol/dm3 (den negativa lösningen kan givetvis förkastas). Detta värde är mindre än 10 % av syrakoncentrationen, och då var förenklingen OK på vår tid. Då blir pH = 2,11.
Enligt engelska Wikipedia är pKa1 =1,25 och pKa2 = 4,14. Dina värden ger pKa1 = 3,22 och pKa2 = 4,82. Kolla upp åtminstone det första värdet!
Med Wikipedias värden på Ka1 blir ekvationen (om x försummas jämfört med 0,1) x2 = 0,0056 och x = 0,075 och det är inte tillåtet att försumma x jämfört med 0,1. En fullständig andragradsekvation är x2 = (0,1-x).0,056 som har (den vettiga) lösningen x = 0,052 d v s pH = 1,28. Detta ligger nästan tre steg från pKa2, så vi behöver inte räkna med denna protolys (vi räknade med att man behöver justera om man är närmare än 2 steg från pKa-värdet).
På min tid skulle vi ha ritat ett logaritmiskt diagram för att se vilka species som kan försummas. Lär man sig sådnat nuförtiden?
Reaktionsformeln är dock fel. HCOO- är inte den korresponderande basen till (COOH)2.
Tack, du har fått mig att återfå skepsisen till ChatGPT. Tänk att jag inte la märke til det! Det är så lätt att inte läsa det som det står, utan det som man tycker att det borde stå.
Smaragdalena skrev:coffeshot skrev:Hej! Återigen till ett tema som min föreläsare missat, men rekommenderat uppgifter kring.
Jag har försökt läsa mig till och kollat på YouTube, men något verkar bli fel :(
"Calculate the pH of the diprotic solution of 0,10M (COOH)2 at ; ignorning the second deprotonation only when the approximation1 is justified:"
1: min bok skriver att om kan den andra deprotoneringen försummas.
Min lösning:
"the approximation" (se ovan) bör inte användas, min bok ger värdena
Jag försöker för det första komma fram till en att sätta upp själva deprotoneringsreaktionen. Det är säkert ännu en gymnasiegrej som jag glömt, men men.
Jag höll tidigare på med ett exempel om H2SO4, där man skrev följande första reaktion
Så jag tänkte först att den första reaktionen för oxalsyran skulle vara:
(COOH)2 --> HCOO-+H+
Men enligt en numera ökad chattbot, ska reaktionera vara:
(dammar av fyra år gammal kunskap från distansundervisningstider, ni får ursäkta mig om jag inte minns det här!)
Men oavsett vem av oss man litar på, borde väl ICE-metodiken för första tabellen åtminstone bli samma princip:
Om vi säger att mitt förslag är rätt och sätter upp ICE:
R (COOH)2 HCOO- H+ I 0,10 C -x +x +x E 0,10-x +x +x ger mig isåfall första lösningen som jag kallar :
Reaktion 2, kommer den då bli:
HCOO- + H2O <-> COO-+H3O+?
Eller tänker jag fel?
Jag har svårt att ställa upp nästa reaktion med andra ord.
Sen får jag sätta upp en till ICE-tabell, inkludera ursprungliga koncentrationen av alla reaktanter från första reaktionen (koncentrationen är ), lösa ut koncentrationen av alla produkter i reaktion 2 och sedan använda för att få fram koncentrationen
Den här gången har faktiskt AI:n rätt. Det du har skrivit är en förenklad variant, men det finns inga fria vätejoner i en vattenlösning, de fastnar på vattenmolekyler så att det bildas oxoniumjoner.
Ditt uttryck för Ka1 ser bra ut. När jag läste kemi (förra årtusendet!) så skulle vi ha försummat x i nämnaren och då skulle man ha fått ekvationen x2 = 0,1.6.10-4 som man löser genom att dra roten ur båda led så att man får x = 0,00775 mol/dm3 (den negativa lösningen kan givetvis förkastas). Detta värde är mindre än 10 % av syrakoncentrationen, och då var förenklingen OK på vår tid. Då blir pH = 2,11.
Enligt engelska Wikipedia är pKa1 =1,25 och pKa2 = 4,14. Dina värden ger pKa1 = 3,22 och pKa2 = 4,82. Kolla upp åtminstone det första värdet!
Med Wikipedias värden på Ka1 blir ekvationen (om x försummas jämfört med 0,1) x2 = 0,0056 och x = 0,075 och det är inte tillåtet att försumma x jämfört med 0,1. En fullständig andragradsekvation är x2 = (0,1-x).0,056 som har (den vettiga) lösningen x = 0,052 d v s pH = 1,28. Detta ligger nästan tre steg från pKa2, så vi behöver inte räkna med denna protolys (vi räknade med att man behöver justera om man är närmare än 2 steg från pKa-värdet).
På min tid skulle vi ha ritat ett logaritmiskt diagram för att se vilka species som kan försummas. Lär man sig sådnat nuförtiden?
Oj, jag vet inte vad för tabell jag läste av imorse. Och det var ändå efter jag druckit mitt morgonkaffe och beundrat synen av ännu en (dock idag regning) morgon! Rätt ska vara rätt,
har jag fått givet. Jag har fått lära mig samma approximation som du, men 5% är det nuförtiden. Jag har inte lärt mig ett logarithmiskt diagram, detta är dock en introducerade universitetskurs i kemi så kan vara därför.
Nu får jag följande svar:

Detta stämmer överrens med facit!!!
Hur ser de reaktioner jag skrivit upp i min lösning ut? Det är möjligt att man kan dra till med förenklingen någonstans, har inte undersökt. Jag väntar på svar från min föreläsare om ekvationslösande miniräknare är OK på tentamen innan jag sätter den (approximationen) i system :P
(aq) ska det stå för oxalsyra i första reaktionen, inte (l).
En vanlig andragradsekvation bör du kunna lösa utan ekvationslösande räknare - annars är det bäst att du repeterar Ma2.
Smaragdalena skrev:En vanlig andragradsekvation bör du kunna lösa utan ekvationslösande räknare - annars är det bäst att du repeterar Ma2.
Haha, det kan jag, jag lovar:)