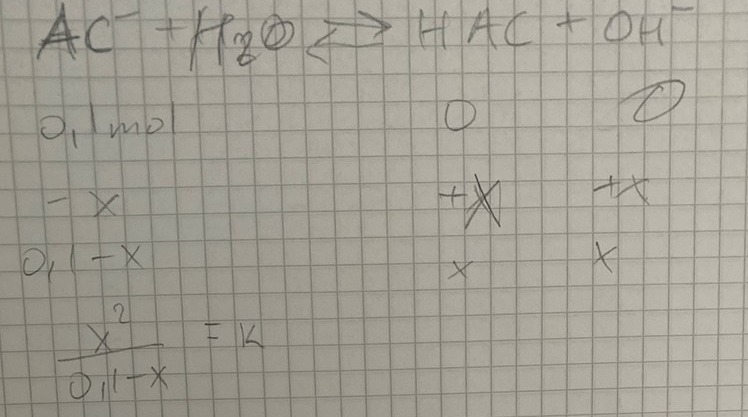PH
Hej!
Jag förstår inte riktigt varför pH värdet blir högre än 7 vid ekvivalenspunkten då man roterar en svag bas med en stark syra och varför pH blir högre än 7 då man titrerar en stark bas med svag syra.
Är du med på at om man blandar lika substansmängder av stark syra och stark bas, så neutraliserar de varandra så att pH-värdet blir 7?
Är du med på att om man titrerar den svaga syran ättiksyra (HAc) med NaOH, som innehåller den starka basen hydroxidjon, så blir resultatet vid ekvivalenspunkten precis likadant som om du hade löst upp natriumacetat NaAc i vatten?
Smaragdalena skrev:Är du med på att om man titrerar den svaga syran ättiksyra (HAc) med NaOH, som innehåller den starka basen hydroxidjon, så blir resultatet vid ekvivalenspunkten precis likadant som om du hade löst upp natriumacetat NaAc i vatten?
nej, nu förstår jag inte. Jag vill förstå mekanismen för just varför det inte blir ett pH värde som är 7 om inte både syran och basen är stark. Skulle du kunna förklara med en reaktionsformel mellan en godtycklig bas samt syra, och på så sätt förklara varför pH värdet blir högre eller lägre? Tack Smaragdalena!!!
Ahmed5349 skrev:Smaragdalena skrev:Är du med på att om man titrerar den svaga syran ättiksyra (HAc) med NaOH, som innehåller den starka basen hydroxidjon, så blir resultatet vid ekvivalenspunkten precis likadant som om du hade löst upp natriumacetat NaAc i vatten?
nej, nu förstår jag inte.
Vad är det du inte förstår?
Jag vill förstå mekanismen för just varför det inte blir ett pH värde som är 7 om inte både syran och basen är stark. Skulle du kunna förklara med en reaktionsformel mellan en godtycklig bas samt syra, och på så sätt förklara varför pH värdet blir högre eller lägre? Tack Smaragdalena!!!
Vi är på väg dit. För att komma fram behöver jag veta om du är med på att lika gärna som att lösa upp (t ex) 0,1 mol HAc och 0,1 mol NaOH i 1 litervatten hade man kunnat lösa upp 0,1 mol NaAc i 1 liter vatten, det går inte att märka någon som helst skillnad mellan de båda lösningarna.
Vilket pH-värde blir det om man löser upp 0,1 mol NaAc i 1 liter vatten? Vet du hur du skall räkna ut detta? Om inte, så tar vi det steg för steg!
Koncentrationen blir 0.1/1 mol/dm3
ph blir bara minus logaritmen av det (har ej miniräknare vid mig just nu)
Nej, du måste räkna med jämviktskonstanten. Första steget är att skriva reaktionsformeln för vad som händer om man löser upp acetatjoner i vatten.
Smaragdalena skrev:Nej, du måste räkna med jämviktskonstanten. Första steget är att skriva reaktionsformeln för vad som händer om man löser upp acetatjoner i vatten.
Ok, kan du visa hur man gör? Det bildas vatten och åskadsrjoner. Är pH 7?

varför kan man inte bara ta - logaritmen på en gång?
Du har inte skrivit vad som händer när en acetatjon hamnar i vatten! Det kommer att ske en reaktion. Denna reaktion gör att du inte bara kan ta minuslogaritmen av koncentrationen för NaAc, eftersom koncentrationen av acetatjoner är annorlunda. Det ger också en förklaring till frågan i ditt förstainlägg.
Alltså, ättiksyra är en svag syra. Det betyder att bara en liten del av ättiksyramolekylerna protolyseras. Vad händer om man löser upp acetatjoner i vatten?
pH värdet blir inte så lågt kanske runt 6-7
Så man kan bara ta minus logaritmen av starka syror och baser utan att behöva göra jämvinrformeln?
Eftersom att bara en liten del prototypernas så bildas relativt lite oxoniumjoner vilket medför att pH värdet inte ändras så nämnvärt?
Nej, nej, nej!!! Det är meningslöst att försöka gissa, du behöver räkna på det! Börja med att skriva en reaktionsformel för reaktionen mellan acetatjon och vatten. Det bildas ättiksyra och ...
Kan man inte bara säga att ifall man har en stark syra och en svag bas så blir den korresponderande syran till basen lite starkare vilket innebär att koncentrationen av den korresponderande syran till basen blir högre än basen och gör lösningen lite sur.
Om basen är stark och syran svag kommer den korresponderande basen till syran vara lite starkare vilket gör lösningen lite mer basisk?

Ahmed5349 skrev:Kan man inte bara säga att ifall man har en stark syra och en svag bas så blir den korresponderande syran till basen lite starkare vilket innebär att koncentrationen av den korresponderande syran till basen blir högre än basen och gör lösningen lite sur.
Om basen är stark och syran svag kommer den korresponderande basen till syran vara lite starkare vilket gör lösningen lite mer basisk?
Nu håller vi på med en svag syra och en stark bas, det andra fallet kan vi spara till senare.
Jag hänger inte med på ditt resonemang. Lite starkare jämfört med vad?
Dina beräkningar ser bra ut. Vad är det för K-värde du skall sätta in, Ka eller Kb?
ka såklart
om man har en svag bas kommer den korresponderande syran till just denna svaga basen vara stark då om man har ett lågt kb värde blir ka för korresponderande syra lite högre. Alltså koncentrationen av den korresponderande syran är högre än koncentrationen av svaga basen
Ahmed5349 skrev:ka såklart
Nej, det är hydroxidjonkoncentrationensom ingår i uttrycket för jämviktskonstanten, inte oxoniumjonkoncentrationen, så konstanten du skall använda heter ...
Ahmed5349 skrev:om man har en svag bas kommer den korresponderande syran till just denna svaga basen vara stark då om man har ett lågt kb värde blir ka för korresponderande syra lite högre.
Nej, den korresponderande basen till en svag bas är en svag syra. Om den aktuella basen hade varit stark, skulle den motsvarande syran inte vara någon syra, lika lite som kloridjoner kan sägas vara en bas (fastän den är korresponderande bas till den starka syran väteklorid).
Alltså koncentrationen av den korresponderande syran är högre än koncentrationen av svaga basen
Nej, det beror helt på vilket pH det är. Det är inget man kan säga generellt. Om pH är högre ln pKa-värdet är koncentrationen av basformen högre. Om pH är lägre ln pKa-värdet är koncentrationen av syraformen högre. Om pH = pKa är de båda koncentrationerna lika.
Smaragdalena skrev:Ahmed5349 skrev:om man har en svag bas kommer den korresponderande syran till just denna svaga basen vara stark då om man har ett lågt kb värde blir ka för korresponderande syra lite högre.
Nej, den korresponderande basen till en svag bas är en svag syra. Om den aktuella basen hade varit stark, skulle den motsvarande syran inte vara någon syra, lika lite som kloridjoner kan sägas vara en bas (fastän den är korresponderande bas till den starka syran väteklorid).
Alltså koncentrationen av den korresponderande syran är högre än koncentrationen av svaga basen
Nej, det beror helt på vilket pH det är. Det är inget man kan säga generellt. Om pH är högre ln pKa-värdet är koncentrationen av basformen högre. Om pH är lägre ln pKa-värdet är koncentrationen av syraformen högre. Om pH = pKa är de båda koncentrationerna lika.
Ok. Men kan inte du visa mig hur man gör, eftersom att jag inte kommer någonstans.
Börja med att reda på Kb-värdet för acetatjonen. (Det brukar bara vara Ka-värden som finns i tabeller, men vet man det är det enkelt att räkna fram Kb.)