På vilket sätt agerar Al(OH)3 som en lewisbas?
Halloj!
Jag håller på att studera några exempel på syra-basreaktioner enligt Lewis definition. Exemplet jag studerar nu är reaktionen:
Enligt författaren agerar aluminiumhydroxiden här som lewisbas, alltså donerar den (tre?) elektronpar till oxoniumjonerna, ett elektronpar till varje oxoniumjon. Jag har försökt rita ut reaktionen men jag förstår inte riktigt hur det bara är ett elektronpar som doneras, det verkar ju som om hela hydroxigrupper doneras:
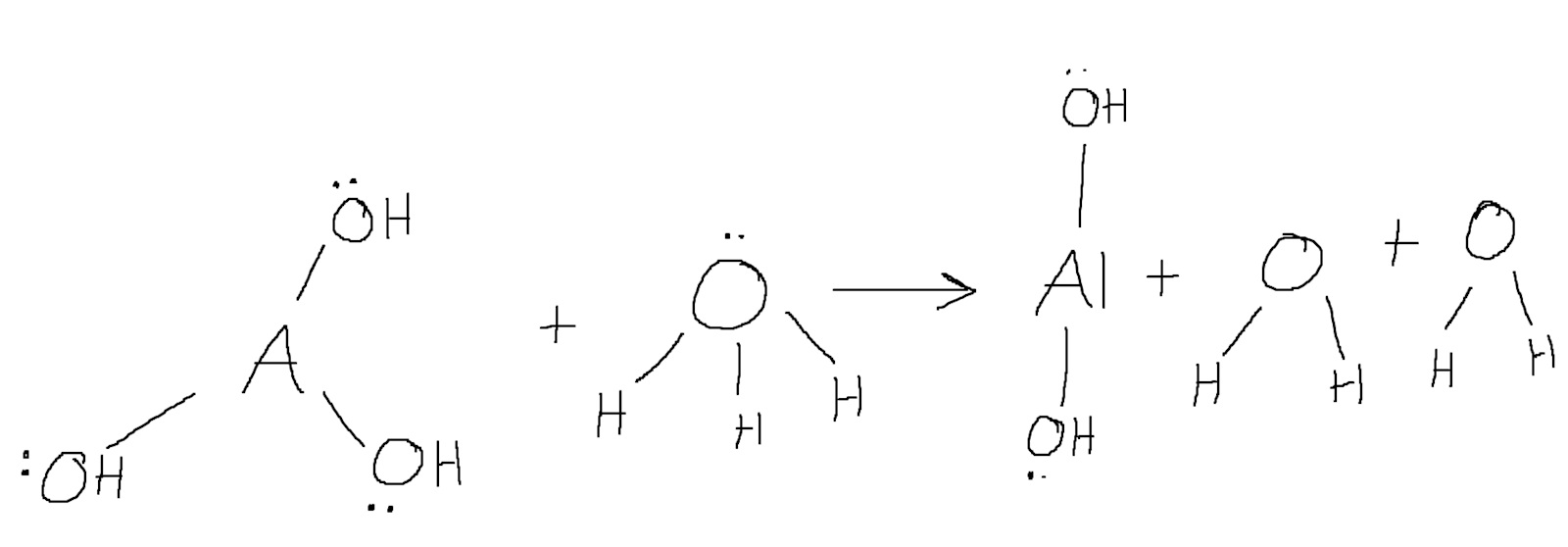
Det är så här jag förstår reaktionen (om man tar det en oxoniumjon i taget).
Det är nog mer korrekt att säga att det är hydroxidjonen som är en Lewisbas.
Ja okej, man tänker alltså att en dissociationen redan har ägt rum så istället för att det är aluminiumhydroxiden direkt som reagerar så hade en mer passande reaktion varit reaktionen nedan?
I så fall kan jag köpa det. Tänker man då att HOMO i hydroxidjonen binder till LUMO i oxoniumjonen eller hur ska man tänka där? Tänker att det kan vara bra att förstå hur det hänger ihop med MO-teori också.
Det ser ut som att du har ritat Al(OH)3 som en molekylförening, men det är ett salt som har låg löslighet i vatten. Därmed får du tänka att det är oxoniumjonerna som transporteras till ytan på Al(OH)3-partiklarna för att reagera. Väl där fungerar ett fritt elektronpar hos hydroxidjonen som Lewisbas som attraherar ett väte i oxoniumjonen. I ett övergångstillstånd är ett H+ halvt bundet till oxoniumjonen och halvt till hydroxidjonen (liknar vätebindning). Till sist binds H+ till hydroxidjonen via HOMO och LUMO.
Det ser ut som att du har ritat Al(OH)3 som en molekylförening, men det är ett salt
Det har du givetvis helt rätt i! Jag fastnade i Lewisstrukturtänket eftersom jag har hållit på med Lewisstrukturer så mycket på senaste. Mitt misstag!
Hur skulle man kunna rita bindningen via HOMO och LUMO som ett diagram? Jag misstänker att det går men jag är lite fundersam, för nu jobbar vi ju inte enbart med atomorbitaler (som när t.ex. två väteatomer går ihop) utan nu finns det ju MO redan i hydroxidjonerna. Hur ska man tänka där?
Tänker att det ser ut som ett molekylorbitaldiagram för en sigma-bindning mellan ett O och ett H. Resultatmässigt alltså, alla elektronerna kommer från syret.



