Oxideras syrejonerna i koppar(II)oxid när koppar(II)oxid kommer i kontakt med 2-propanol?
Hej!
Jag har gjort en laboration där ett kopparbleck först upphettades så att koppar(II)oxid bildades på dess yta.
Sedan lades kopparblecket i 2-propanol och kopparblecket fick tillbaka sin "kopparfärg" på ytan.
Har jag förstått det rätt om jag tänker:
1. Kopparatomerna på ytan oxideras först till gulröd Cu2O och sedan till svart CuO
2. Vid kontakt med 2-propanol oxideras syrejonerna i CuO till syremolekyler och kopparjonerna reduceras till kopparatomer
3. Halva syremolekylen reagerar med väteatomen i OH-gruppen + väteatomen på kolatomen i direkt anslutning till OH-gruppen
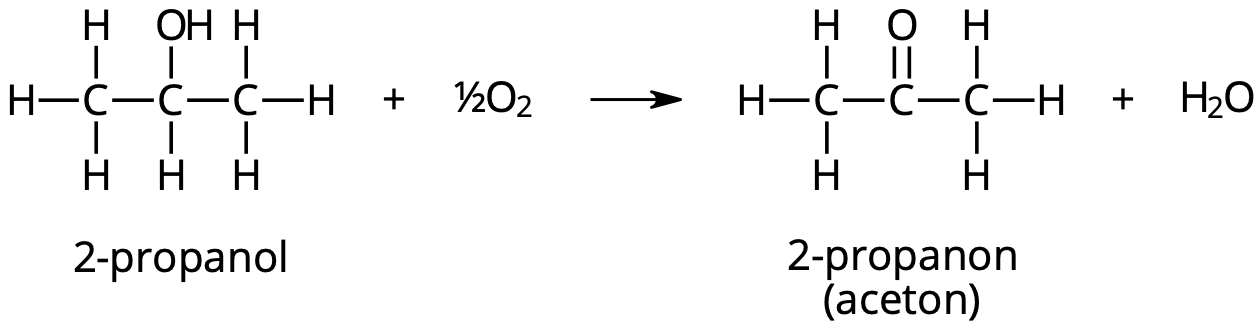
4. Syreatomen binds med dubbelbindning till kolatomen och kolatomen (där OH-gruppen tidigare satt) oxideras
5. Bildas 2-propanon (aceton) och vatten.
Det är främst steg 2 som jag är osäker på om det stämmer.
Tack på förhand!
Hej!
Det är inte syret i koppar(II)oxid som oxideras, utan kolet som binder till syret i propanolen. Dess oxidationstal går från 0 till +2. Koppar reduceras samtidigt från +2 i CuO till +1 i Cu2O.
Hej!
Tack för svar!
En följdfråga: Vad är det som får kolatomen att oxideras?
Ytterligare en följdfråga: Den halva syremolekylen som reagerar med väteatomen i OH-gruppen och väteatomen på kolatomen i direkt anslutning till OH-gruppen, den kommer väl isåfall inte från koppar(II)oxiden utan istället från luften?
Det sker en reaktion mellan koppar(II)oxid och 2-propanol. När de kommer nära varandra sker reaktionen eftersom det är termodynamiskt gynnsamt, dvs det leder till en sänkning av Gibbs fria energi. Exakt hur reaktionsmekanismen ser ut vet jag inte, kanske det går att googla fram. Jag skulle killgissa att vätet i OH-gruppen doneras till syret i koppar(II)oxiden, vilket gör att syret i propanolen kan skapa en dubbelbindning till kolet.
Det sker ingen reaktion med syrgas i ditt exempel med koppar(II)oxid, då kommer syret från kopparoxiden istället. Reaktionsformeln visar en reaktion mellan 2-propanol och syrgas, vilket alltså inte är samma reaktion. Ibland kan man se samma formel fast med [O] som reaktant istället för 1/2O2 som i ditt fall. När man skriver [O] innebär det oxidation där det tillkommer syre från något oxidationsmedel, vilket kan vara syrgas eller koppar(II)oxid.
Isåfall ser reaktionsformeln där syret kommer från koppar(II)oxid ut så här?
C3H7OH + [O] → C2H6CO + H2O
Eller om kopparjonerna är med?
C3H7OH + CuO → C2H6CO + Cu2O + H2O
Precis, men din andra formel är inte balanserad.
Är det bättre så här?
C3H7OH + 2CuO → C2H6CO + Cu2O + H2O
Ja nu är det rätt :)
Tack så mycket för hjälpen!


