Oxidationstal NO3-
I en uppgift i boken ska man ange oxidationstal för varje atom i NO3-. Enligt boken ska man anta att syre nästan alltid har oxidationstalet -II, då räknade jag ut att N har oxidationstalet +V (x - 6= -1, x = 5) och det stämde med facit. Jag hade dock lite svårt att se molekylen framför mig med oxidationstalen och jag vill gärna första bättre hur det funkar.
Bilden visar vad jag skulle tro är rätt men eftersom att boken varken går igenom det eller visar något så vet jag inte.  Syreatomerna tar emot två elektroner var och får därför -II. De har högre elektronnegativitet och drar till sig elektronerna i bindningarna och sen drar två syreatomer till sig varsin elektron från omgivningen för att få 8 valenselektroner. N får +V eftersom den "tappar" elektronerna i bindningarna till syreatomerna och ger ifrån sig en elektron till omgivningen för att få 8 valenselektroner.
Syreatomerna tar emot två elektroner var och får därför -II. De har högre elektronnegativitet och drar till sig elektronerna i bindningarna och sen drar två syreatomer till sig varsin elektron från omgivningen för att få 8 valenselektroner. N får +V eftersom den "tappar" elektronerna i bindningarna till syreatomerna och ger ifrån sig en elektron till omgivningen för att få 8 valenselektroner.
Jag undrar då om någon kan bekräfta att det stämmer eller förklara hur N får oxidationstalet V+ och syre -II.
Så här ritas det upp i Wikipedia: 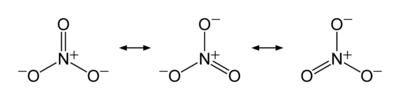 Ja, kväveatomen har oxidationstalet +V i nitratjonen.
Ja, kväveatomen har oxidationstalet +V i nitratjonen.
Nitratjonen är inte en molekyl, det är en jon. Den är dessutom lite knepig, för som du verkar ha upptäckt ser inte bindningarna ut att ”gå ihop” första gången man tittar på strukturformeln.
Jonens struktur är en resonansstruktur:
 Kväveatomen har i sitt neutrala tillstånd fem valenselektroner och kan maximalt omges av åtta stycken elektroner. Tyngre atomer från period 3 och nedåt kan kringgå denna regel eftersom de har tillgång till s.k. d-orbitaler, men det är alltså inte fallet för kväve, eller syre för den delen. Atomerna måste alltså kombineras så att de omges av max åtta elektroner. Det ena syret binder dubbelt till kväveatomen och ger därmed kväveatomen två extra valenselektroner. Den andra syreatomen har fått en extra elektron utifrån och binder till kväveatomen med en enkelbindning. Då omges kväveatomen redan av åtta valenselektroner, så frågan är hur man får in en tredje syreatom i strukturen.
Kväveatomen har i sitt neutrala tillstånd fem valenselektroner och kan maximalt omges av åtta stycken elektroner. Tyngre atomer från period 3 och nedåt kan kringgå denna regel eftersom de har tillgång till s.k. d-orbitaler, men det är alltså inte fallet för kväve, eller syre för den delen. Atomerna måste alltså kombineras så att de omges av max åtta elektroner. Det ena syret binder dubbelt till kväveatomen och ger därmed kväveatomen två extra valenselektroner. Den andra syreatomen har fått en extra elektron utifrån och binder till kväveatomen med en enkelbindning. Då omges kväveatomen redan av åtta valenselektroner, så frågan är hur man får in en tredje syreatom i strukturen.
Lösningen är att kvävet donerar en elektron till tredje syret så att det blir en plats över där syret kan binda med en enkelbindning. Då har tredje syret fått en ”gratis” elektron, vilket innebär att det syret får en formell laddning på -1. Kollar vi nu på kvävet så binder det till syreatomer med totalt fyra bindningar och den ”förlorar” i samtliga fall eftersom syre är mer elektronegativt, dvs det finns en förskjutning av elektronerna mot syrena. Dessutom har kvävet donerat en elektron till en av syreatomerna. Totalt har alltså kvävet tappat 4+1=5 elektroner till syrena och oxidationstalet blir +V. Kvävet får dessutom en formell laddning på +1 på grund av den donerade elektronen.
Man kan tycka att detta verkar märkligt och instabilt, vilket det också är. Nitratjonen är ganska reaktiv och oxiderande. Däremot finns det tre olika sätt att rita upp situationen som du kan se i figuren ovan, dvs de finns tre olika resonansstrukturer. Eftersom det finns resonans hos jonen verkar det stabiliserande då laddningarna kan spridas ut över ett större område inom molekylen. På så sätt går det att skapa en nitratjon även om den är förhållandevis reaktiv.
Tack, jätte bra svar. Synd att det inte står sådär i boken.
På en webbsida (https://www.chemguide.co.uk/atoms/bonding/shapesdouble.html) hittade jag en bild som såg ut såhär: 
(grön prick är en elektron utifrån)
Resultatet verkar bli likadant men hittills har jag inte stött på en sådan enkelbindning där båda elektronerna kommer från samma atom, bara för att vara säker undrar jag om detta är något som förekommer och om svaret i bilden också är rätt.
Ja, resultatet blir samma så figuren är rätt. Däremot kan man inte särskilja vilka elektroner som kommer från kvävet och vilka som kommer från syrena. I figuren har man använt olika färger för att skilja mellan dem, men i verkligheten är alla elektroner identiska och hoppar runt mellan atomerna.
När bindningselektroner enbart kommer från den ena bindande atomen kallas det för dativbindning. Det är fortfarande en kovalent bindning, men just denna typ av bindning har fått ett ”specialnamn”.
Okej, dina svar hjälpte mycket, tack!



