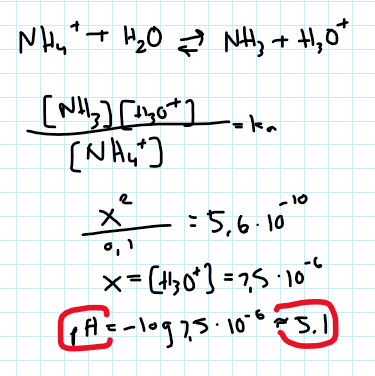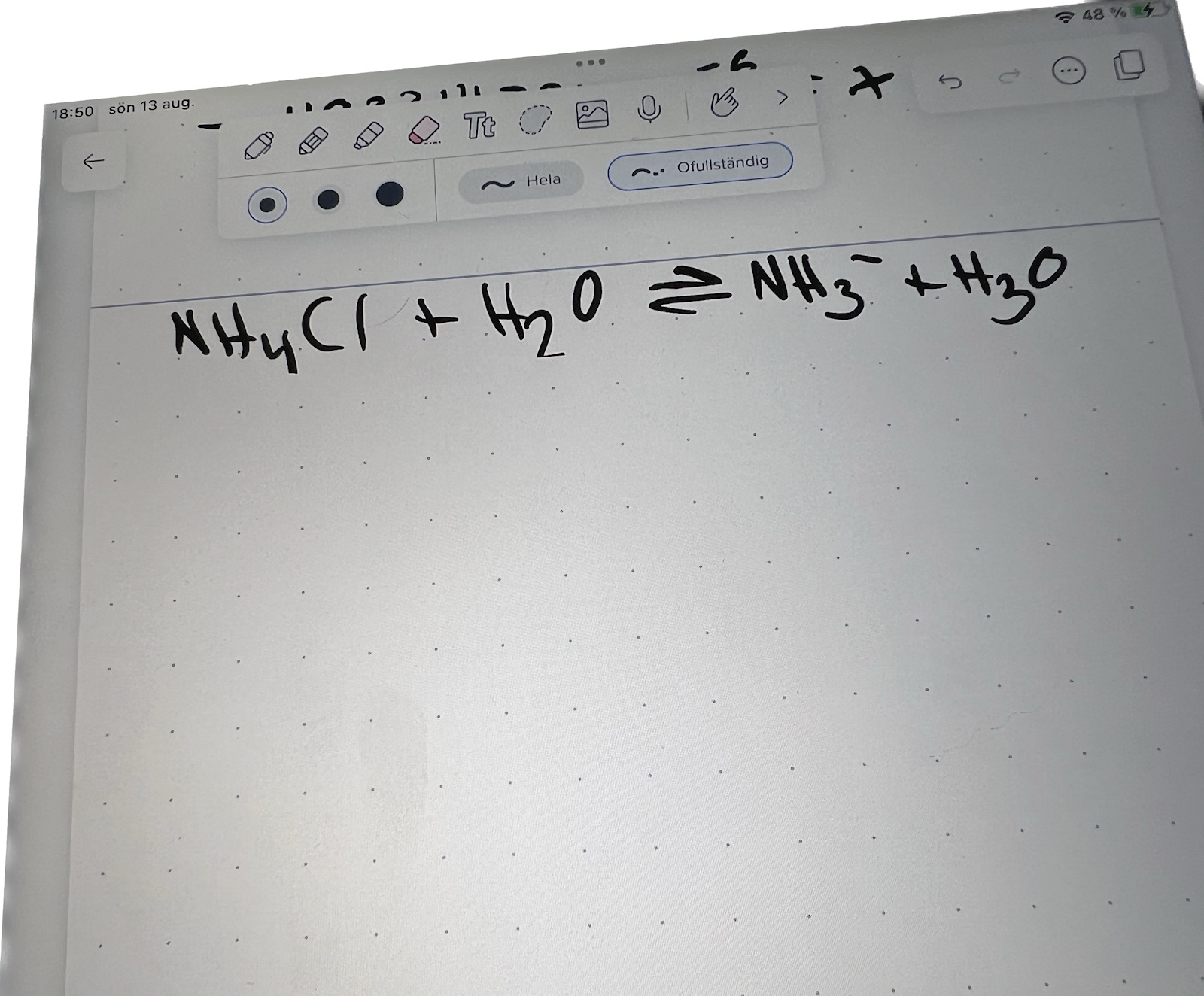övningstenta fråga
Hej skulle någon kunna förklara hur man ska beräkna denna gamla tenta frågan

mvh en förvirrade studen
Är du med på att vi får NH4+-joner och Cl--joner i vattenlösning? Vad händer när NH4+ reagerar med vatten?
NH4+ ger en väte till vatten så att det blir h3o+
Stämmer. Hur många mol NH4+ får vi per mol NH4Cl? Hur många mol H3O+ får vi per mol NH4+?
nu förstår jag inte
Skriv en balanserad reaktionsformel för upplösningen av jonerna i vattnet. Skriv sedan en balanserad reaktionsformel för när NH4+ reagerar med vatten. Vilka är molförhållandena?
för jag har cl- kvar så hur ska jag göra då
För att det ska bli extra tydligt vad man gör kan man skriva en reaktion för upplösningen och en för syra/bas-reaktionen.
Upplösning: NH4Cl <=> NH4+ (aq) + Cl- (aq)
Syra/bas: NH4+ + H2O <=> NH3 + H3O+
Vilka är molförhållandena i den första reaktionen? I den andra?
i den första är förhållandet 1:1
och i den andra är det också 1:1
Bra. Eftersom volymen lösning är konstant kommer koncentrationen vara proportionerlig mot substansmängden. Hur stor koncentration H3O+ har vi då tillslut?
samma mängd som för nh3
Men den koncentrationen har vi inte. Vi måste utgå från informationen i uppgiftsbeskrivningen.
det är 0,10 M DÅ KONCENTRATIONEN DEN HAR
Ja, eftersom förhållandet är 1:1 i bägge reaktioner.
Blir svaret ungifär 5,1 i ph
Jag har inte gjort några beräkningar men inser nu att jag förklarat som om det vore en stark syra. Det är det inte. Rätt lösningsgång är att ställa upp en jämviktsbalans och beräkna koncentrationen H3O+ därifrån.
Här är en slarvig uträkning från min sida. Ledsen om jag förvirrade dig med allt jag skrivit ovan. Svaret blir ca 5,1 precis som du beräknat!