Ordna efter sjunkande polaritet
Jag har följande föreningar:
N2O5
P4O6
KF
BN
F2
HCl
och ska ordna dem efter sjunkande polaritet med den tydligaste kovalenta bindningen först.
F2 är ren kovalent bindning, dvs fullständigt opolär.
KF är jonbindning.
Men hur ska de övriga rangordnas med avseende på polaritet?
Räcker det att kolla på elektronegativiteten? Ska man kolla strukturen med VSEPR-metoden också (isåfall hur ser P4O6 ut? och BN?)
N2O5 delta elektronegativitet: 0,4
P4O6 delta elektronegativitet: 1,3
BN delta elektronegativitet: 1,0
HCl delta elektronegativitet: 0,9
HCl är en dipol.
Blir N2O5 linjär molekyl och isåfall opolär?
Jag vet inte riktigt hur jag ska tänka...
Dikvävepentoxid är inte en linjär molekyl, utan den ser ut ungefär så här:
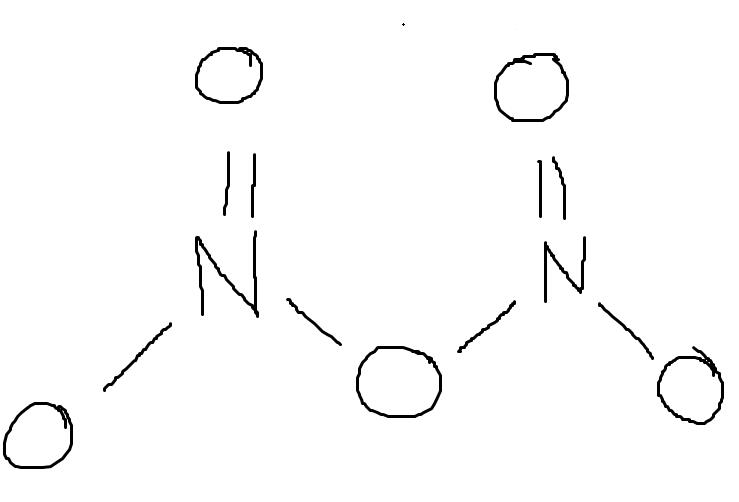
Så denna molekyl kanske har viss dipolkaraktär eftersom det finns tre syreatomer under kvävena men bara två ovanför. Men den kommer antagligen inte ha ett särskilt stort dipolmoment eftersom syre inte är mycket mer elektronegativt än kväve och eftersom den i stora drag är symmetrisk.


