Orbital hydbrisering
Hej, jag har förstått att orbital hydbrisering är när orbitaler smälter samman och får en ny form för att elektronerna ska vara jämt fördelade runt kärnan. Om vi tex tar kol som har atomnummer 6, 6 protoner, 6 elektroner (Grundtillstånd).
1s fylls på, 2s oxå, 2 st elektroner kvar som vi kan placera i 2Px och 2py orbital, men 2pz får inga elektroner. En elektron från 2s-orbitalen "hoppar" därför upp till 2pz-orbitalen. Detta resulterar i att vi har en elektron i varje av 2s, 2px, 2py, och 2pz.
1 2s-orbital och tre 2p-orbitaler blandas för att bilda 4 sp^3-hybridorbitaler.
Dessa ger en tetrahedral form - Mellan varje orbital form finns det en vinkel som är 109.5 grader. Bildas sigma bindning : ja 4 stycken
Men hur illustrerar man detta?
Mattehjalp skrev:Hej, jag har förstått att orbital hydbrisering är när orbitaler smälter samman och får en ny form för att elektronerna ska vara jämt fördelade runt kärnan. Om vi tex tar kol som har atomnummer 6, 6 protoner, 6 elektroner (Grundtillstånd).
1s fylls på, 2s oxå, 2 st elektroner kvar som vi kan placera i 2Px och 2py orbital, men 2pz får inga elektroner. En elektron från 2s-orbitalen "hoppar" därför upp till 2pz-orbitalen. Detta resulterar i att vi har en elektron i varje av 2s, 2px, 2py, och 2pz.
1 2s-orbital och tre 2p-orbitaler blandas för att bilda 4 sp^3-hybridorbitaler.Dessa ger en tetrahedral form - Mellan varje orbital form finns det en vinkel som är 109.5 grader. Bildas sigma bindning : ja 4 stycken
Men hur illustrerar man detta?

Hej, tack för bilden. Men jag menar att här (se bild nedan) har de försökt illustrera hur kolatomer delar på elektroner mellan varandra för att bilda sigma bindningar i sp och sp^2 hydbrisering. Men förstår inte riktigt bilden. Vad innebär pilarna upp och ner osv och varför har etyn 6 orbitaler medans eten har 5 orbitaler.

Varken i eten eller etyn är kolatomerna sp3-hybridiserade - det är bara när man har enkelbindningar som det är sp3-hybridisering. För att kunna bilda dubbbel- eller trippelbindingar behöver det finnas p-orbitaler kvar, om det finns en p-orbital kna det bildas en sigma- och en pibindning, d v s två bindningar totalt, och om det finns två p-orbitaler kvar kan man bilda två pi-bindningar och en sigmabindning, d v s tre bindningar totalt.
Sigmabindningar är när elektronerna (förenklat) befinner sig på linjen mellan de båda bindande atomerna. Pibindningar är när elektronerna finns både "ovanför och under" linjen mellan de båda atomerna - det är alltså en sigmabindning som jag har markerat med rött, och EN pibindning som jag har markerat med ljusblått här:
I trippelbindningen är det en sigmabindning, en pibindning som är ovanför och nedanför i papprets plan, och en pibindning som är över och under pappret.
Så om jag ska rita sp^3 hydbrisering så ska jag rita 4 orbitaler bara? Hur får jag då de 4 sigma bindningar
Det kan t ex vara de fyra enkelbindningarna till väteatomerna i en metanmolekyl.
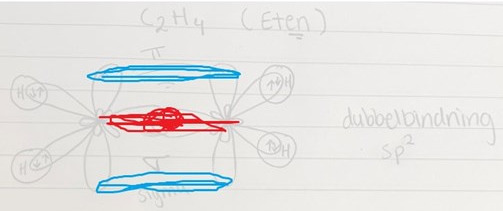
okej vill kolla om jag tänkt rätt. Lila= sigma bindning grön=pi bindning
totalt har eten 3 sigma bindningar och 1 pi bindning

Etyn= 2 pi bindningar och 3 sigma. (Glömde rita en lila streck nere såsom den längst upp, men den ska finnas där)

Mattehjalp skrev:okej vill kolla om jag tänkt rätt. Lila= sigma bindning grön=pi bindning
totalt har eten 3 sigma bindningar och 1 pi bindning
Etyn= 2 pi bindningar och 3 sigma. (Glömde rita en lila streck nere såsom den längst upp, men den ska finnas där)
Nej, det ser inte alls rätt ut. Vilken hybridisering har koatomerna i eten repektve etyn?
Etan har ju sp^2 hydbrisering och etyn sp hydrbriseging
Ja. Då måste du rita dessa hybridorbitaler och kombinera dem till molekylorbitaler.
Hur ritar jag det?
Så etyn har inte 3 sigma och 2 pi?
Tillägg: 15 aug 2024 14:37
Såg nyss detta. Hade för mig att varje enkelbildning är sigma bindning därav räknefelet.
Sp^2 hydbrisering sker på alkener (dubbelbindningar) och bildar 1 sigma bindning och en pi bindning. Den återstående p-orbitalen(den som inte deltar i hybridiseringen, t.ex. 2pz) från varje kolatom överlappar sidledes och bildar denna pi-bindning Samma process bara att nu är det 1 2s orbital och två 2p (kan vara 2Px eller 2py eller 2pz, ingen regel liksom, blanda hur som) och 2 2p orbitaler blands för att skapa 3 sp^2orbitaler. Dessa får trigonal plan geometri (120°) mellan varje orbital.
Sp hydbrisering sker på alkyner(trippelbindningar) bildar 2 pi bindningar och 1 sigma (sigma bildas av orbitalerna som deltog i hydbrisering och pi bindningar bildas av resterande 2 p orbitaler som ej deltog, då de överlappar varandra sidledes (x,y,Z). Samma process men 1 2s orbital och 1 2p orbital bladas ist för att skapa 2 sp orbitaler. Får linjär geometri med 180 grader mellan varje orbital.
Mattehjalp skrev:Så etyn har inte 3 sigma och 2 pi?
Mellan kolatomerna är det en sigmabindning och två pibindningar. De båda bindningarna kol-väte är sigmabindningar. Så man kan säga att det är "3 sigma och 2 pi" om man blandar ihop kol-kol och kol-vätebindningar, men det känns långsökt.
Så när man pratar om sp sp^2 osv hydbrisering så pratar vi oftast om bindningarna som skapas mellan kolatomerna?
Mattehjalp skrev:Så när man pratar om sp sp^2 osv hydbrisering så pratar vi oftast om bindningarna som skapas mellan kolatomerna?
Ja, sp3-, sp2- och sp-hybridisering används för att förklara hur kol kan bilda fyra bindningar (om man räknar dubbelbindning som två och trippelbindning som tre).
Tusen tack!!



