När x, när 2x om okänd subsansmängd av produkt?
Hej! Jag har två olika exempel där man har en okänd mängd av ett ämne:
1. I en behållare med volymen 50,0 dm3 infördes 1,00 mol kolmonoxid och en okänd substansmängd väte. Gasblandningen upphettas till en viss temperatur. Ämnena reagerar och bildar metanol, CH3OH, enligt formeln CO(g) + 2 H2(g) ⇄ CH3OH(g). Jämviktskonstanten är vid denna temperatur 247 (mol/dm3)-2. När jämvikt ställt in sig finner man att gasblandningen innehåller 0,40 mol metanol. Hur stor substansmängd vätgas hade man infört?
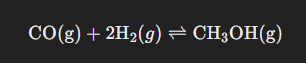
2. Vid hög temperatur kan kväve och syre bilda kväveoxid enligt följande jämviktsformel
N2(g) +O2(g)-> 2NO(g)
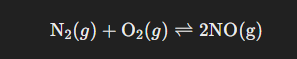
Vid 2500 grader är jämviktskonstanten för denna gasjämvikt 7,9*10^-3
Hur stor substansmängd NO innehåller systemet vid jämvikt och vid temperaturen 2500 grader om man utgår från 1 mol N2 och 1 mol O2?
-----------------------------------------------------------------------------------------------
På uppgift 1 blir svaret rätt om du sätter koncentrationen för H2 som x, även fast det står en 2:a framför, medan det i uppgift 2 blir rätt om du sätter okända NO som 2x, för det står en 2:a framför. Vad är skillnaden på uppgifterna?
1. De frågar efter substansmängden H2. Det är då lämpligt att kalla den t.ex x.
2. De frågar efter substandmängden NO vid jämvikt. Kalla den x. Reaktionsformeln ger då substansmängderna N2 och O2 vid jämvikt.


