Mekanism för bildning av acetylsalicylsyra, hybridisering m.m.
Halloj!
Jag sitter med uppgiften nedan (men vi jag skippar c för jag tror det är en felskrivning):
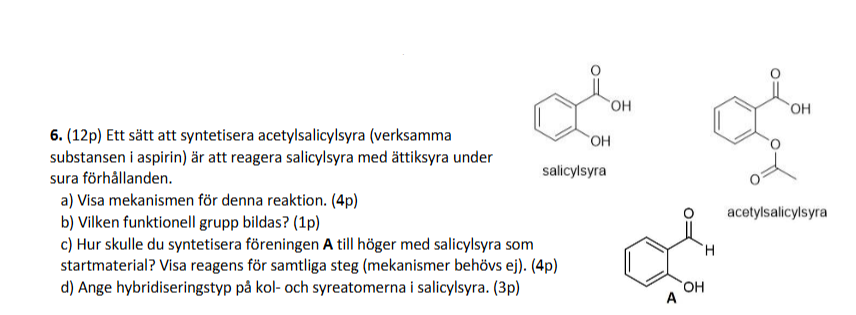
Nedan följer en bild med mekanism och svar på b) och d). Har jag tänkt rätt eller är något felaktigt?

a) ser bra ut.
b) du svarar inte på frågan om vilken grupp det är som bildats, utan vilken typ av bindning. Använd "grupp" i svaret så får du 1p.
c) tror jag inte är en felskrivning, för sytensen av A går att göra.
d) stämmer bra.
I a) skulle du med fördel kunna förkorta allt utom OH-gruppen i salicylsyran som R så slipper du rita så mycket 🙂
Men väldigt bra ritad mekanism i övrigt!
b) du svarar inte på frågan om vilken grupp det är som bildats, utan vilken typ av bindning. Använd "grupp" i svaret så får du 1p.
Jag tyckte det var en lite konstigt ställd fråga. Jag förstår inte om de syftar på hela "estergruppen" med "estersyret" i eller om de bara syftar på acylgruppen som sitter där vätet satt på salicylsyran.
c) tror jag inte är en felskrivning, för sytensen av A går att göra.
Det har du helt rätt i! Jag tittade på bilden minst ett dussintal gånger men såg fel varje gång - såg inte att de hade bytt ut -OH på karboxylgruppen mot ett väte.
Ska fundera kring c) och återkomma.
Angående c), är det rimligt att tänka att man vill försöka reducera kolet i karboxylgruppen? Jag såg något exempel där man använde typ LiAlH4, där AlH4- gav bort ett väte och två bindningselektroner till vätet på -OH på karboxylgruppen och fick den att avgå som vätgas. Sedan kunde AlH3 genom att sno karbonylsyret och ge bort en väte "avsluta jobbet".
Jag vet att det var en lite konstig förklaring men är det rimligt att det är ungefär en sådan reaktion de vill ha? Vad kallas en sådan reaktion i så fall?
Alltså något i stil med detta:

Helt rätt att vi vill göra en reduktion! Och ett väldigt populärt reduktionsmedel är just LiAlH4, som lite förenklat fungerar som en någorlunda stabil och hanterbar källa till hydridjoner.
Den kan mycket riktigt reducera karboxylsyror till aldehyder, så som du har ritat, men i praktiken kommer det vara svårt att hindra den från att reducera kolet ytterligare ett steg, så att man får en alkohol i slutändan. Se exempelvis den här sidan:
Det är möjligt att det finns andra mer sofistikerade reduktionsmedel som klarar att reducera karboxylsyror till aldehyder utan att gå hela vägen till alkohol, men det går utöver mina kunskaper.
Däremot finns det bra oxidationsmedel som klarar att oxidera alkoholer till aldehyder utan att gå hela vägen till en karboxylsyra, till exempel DMP eller PCC:
Så jag hade nog föreslagit en tvåstegssyntes:
1) Reduktion med LiAlH4.
2) Oxidation med DMP.
Ja okej, så i vårt fall hade det varit svårt att hindra LiAlH4 att reducera vår karboxylgrupp hela vägen till:

Varför är AlH4- ett så himla starkt reduktionsmedel? Är det på grund av att jonen väldigt gärna "blir av" med sitt laddningsöverskott?
En hydridjon är extremt instabil. Att binda till aluminium stabiliserar den lite grann, men det frigörs mycket mer energi om den binder till en vätejon (så att det bildas vätgas) eller ett karbonylkol.
Tillägg: 16 mar 2025 21:29
Här finns en rätt intressant diskussion om hur LiAlH4 fungerar, inklusive lite kul anekdoter om hur krångligt det är att jobba med:
https://www.masterorganicchemistry.com/2023/02/03/lialh4-lithium-aluminum-hydride/
Tillägg: 16 mar 2025 22:46
Dessutom skulle man kunna argumentera för att både reduktionen till aldehyden och alkoholen delvis också drivs av det uppstår starka O-Al-bindningar. (Detta tycker jag saknas i din mekanism för reduktionen till alkoholen. Det bildas en alkoxidjon som binder till aluminium, och det är först när reaktionen är klar och man upparbetar med sur vattenlösning som det finns tillgängliga vätejoner.)
Jag googlade runt lite, och det verkar som att estrar är lite enklare att reducera selektivt till aldehyder, genom en neutral släkting till AlH4- som kallas för DIBAL (det finns dock fortfarande en risk att man råkar få alkoholen):
https://www.masterorganicchemistry.com/2011/08/26/dibal-di-isobutyl-aluminum-hydride/
Så en alternativ tvåstegssyntes skulle kanske kunna vara följande:
1) Esterfiering till acetylsalicylsyra.
2) Försiktig reduktion med DIBAL.



