Masshalt
"Man löser 2,60 g aluminiumklorid AlCl3 i 200 g vatten. Hur stor blir masshalten aluminium (i form av aluminiumjoner) i lösningen?"
Hej! Jag skulle behöva hjälp med denna frågan då jag inte förstår hur jag ska börja.
masshalt = (massan av upplöst ämne)/(lösningens massa). Det är alltså inte vattnets massa som skall vara i nämnaren, utan lösningens. Det är bara massan av aluminiumjonerna (inte aluminiumkloriden) som skall vara i täljaren.
Behöver du mer hjälp, så visa hur långt du har kommit och fråga igen.
Jag förstår inte vad du menar, jag vet inte hur jag ska få reda på massan av det upplösta ämnet.
Massan av det upplösta ämnet står i uppgiften - "2,60 g aluminiumklorid AlCl3". Hela lösningen har alltså massan 202,6 g.
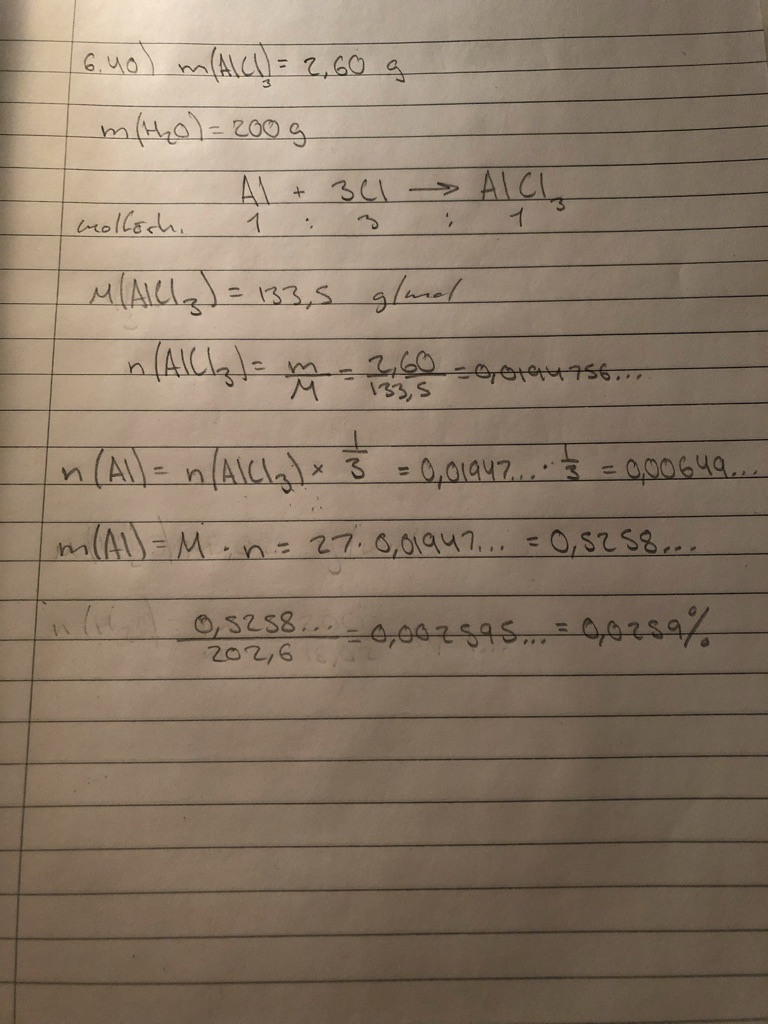
Jag får det till 0,0259% och avrundat till 0,0260% dock är svaret 0,260%. Ser inte vart jag gjort fel..
Substansmängden aluminiumklorid är 2,60/133,3 = 0,0195 mol. 1mol aluminiumklorid innehåller 1 mol aluminiumjoner, så substansmängden aluminiumjoner är också 0,0195 mol. 0,0195 mol aluminium har massan 0,0195.27,0 = 0,527 g. Masshalten är 0,527/202,6 = 0,00260 = 0,260 %, som facit säger.
Förutom en del konstigheter med 1/3 som jag inte förstår i dina uträkningar är det enda fel du har gjort att de flyttade kommat ett steg i stället för två när du gjorde om till procent.
Hur blir det 0,260%? Räknar man inte ut procent genom 10 * 0,00260?
Procent betyder hundradel, inte tiondel.


