Magnesiumoxid
När magnesium brinner reagerar sker en redoxreaktion där magnesium oxideras (avger 2 valenselektroner) medan syre i luften reduceras (tar upp 2 valenselektroner). Det bildas ett vitt pulver - MgO. För att redoxreaktionen ska starta tillför man aktiveringsenergi (dvs värme). Min fråga är vad som sker då? Innan "jonerna" reagerar med varandra. Metallbindningar måste brytas, elektroner måste exciteras etc. I vilken ordning sker händelseförloppet? Är det någon som kan förklara STEG för STEG. :)
Det här är en mycket intressant fråga eftersom jag tror att det finns inte den enkla och konkreta svar som man kan ge som i vissa reaktioner av organisk kemi.
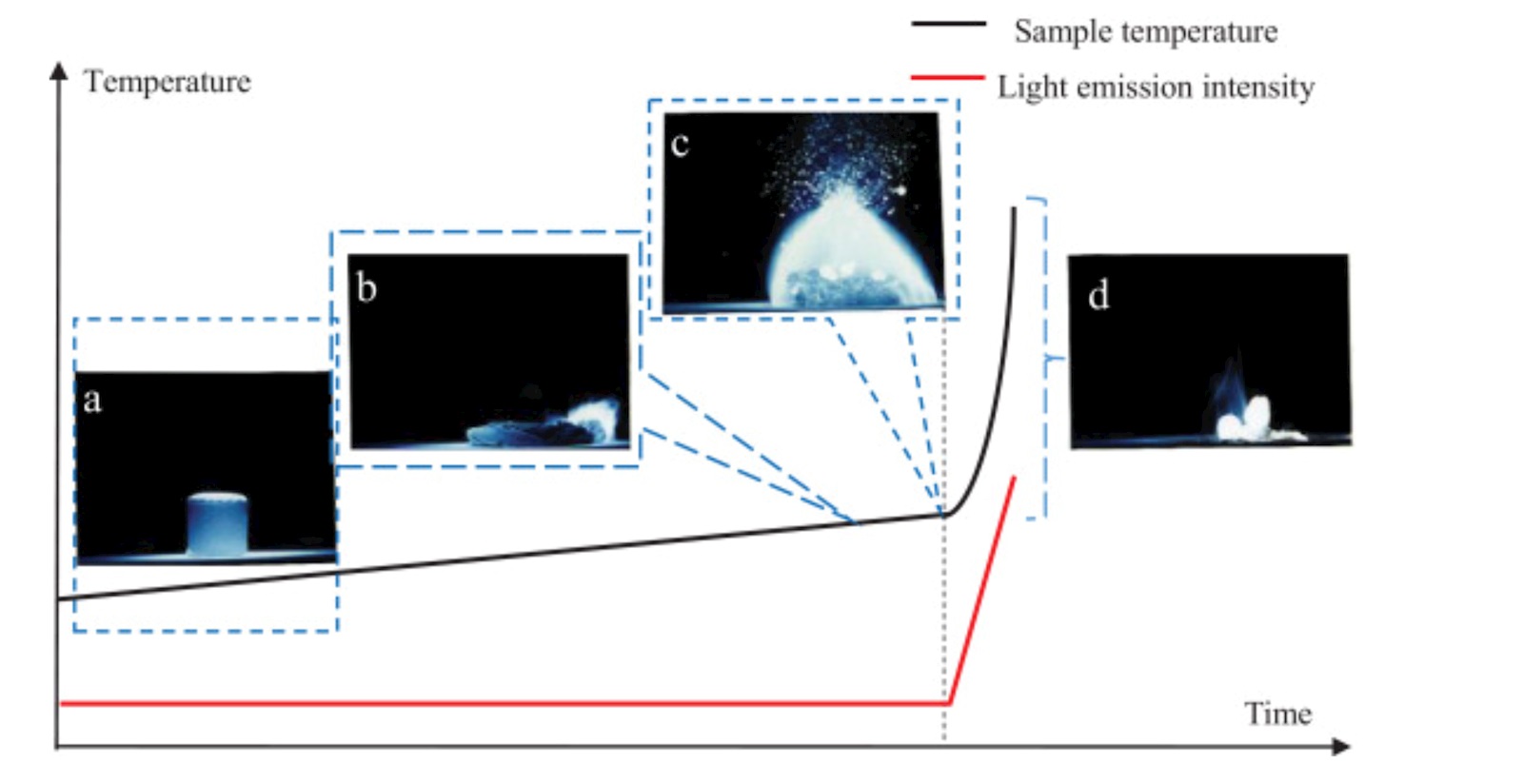
I början är magnesium skyddat av en oxidfilm. När metallen värmas så börjar den smälta vilket ger sprickor i oxidfilmen där magnesium kommer fram. Vid en viss temperatur kokar metallen och det bildas magnesium ånga.
I denna fasen bryts metallbindningar.
När magnesiumatomer kommer i kontakt med syre ger det en mycket exoterm reaktion och snabbt uppstå temperaturer upp till 3500°C. Man brukar säger att den förbränningsoxidationen är "våldsam".
Vad betyder det?
Om man vill tänker sig nu att en magnesiumatom närmar sig en O2-molekyl så kan de liksom biljardkulor reagerar med varandra. I en teoretisk modell kunde man tänker sig att magnesiumatomen klyver syremolekylen och förbinder sig med den ena medan den andra flyger iväg som neutral syre enkel atom. Det beskriver antagligen den principiella reaktionsmekanism. Men så enkelt är det inte.
I verklighet förångas inte en magnesiumatom för sig, men de lämna ytan i små grupper av 1, 2, 3, 4, 5.... magnesiumatomer som kommer i kontakt med syre. Vid temperaturer i regionen 3500°C bryts de mesta bindningar och atomerna kolliderar "vild" och med hög hastighet med varandra. Elektromagnetisk strålning emitteras, bland annat ljus och värme.
Det går bra att utreda detaljerade mekanismer för vissa reaktioner, men förbränning är mer typ "mass-happening" där många saker händer samtidigt mellan många olika molekylkonstellationer som kolliderar vid hög hastighet med varandra. Vid reaktion med luft är brinnande magnesium så aggressivt att den även reagerar med kväve och CO2.
När förbränningsgaserna kylar ned bildar sig så småningom produkterna först som rök av små partiklar som sedan fallar ner som ask.
Nedan finns en bild vad händer när man värmer en liten magnesiumbit. Först smälter den och när det blir ånga uppstår en flamma och värme.
Jag hoppas det svara på din fråga.
 https://www.sciencedirect.com/science/article/pii/S2213956720300335
https://www.sciencedirect.com/science/article/pii/S2213956720300335


