Lewissyra och lewisbas
H2O2 reagerar med SO3 och bildar H2SO5 i en Lewis syrabasreaktion.
a. Rita Lewisstrukturerna av reaktanterna och produkten.
b. Avgör vilket ämne som är Lewissyra respektive Lewisbas.
a. Jag har ritat Lewisstrukturerna:
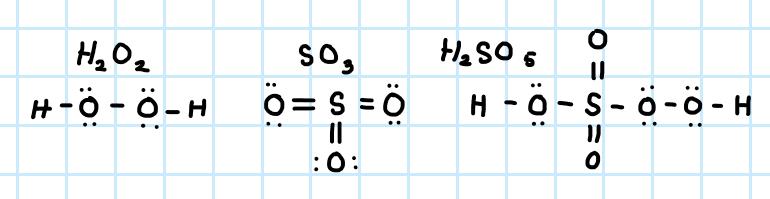
Facit säger dock att SO3 ser ut på följande sätt: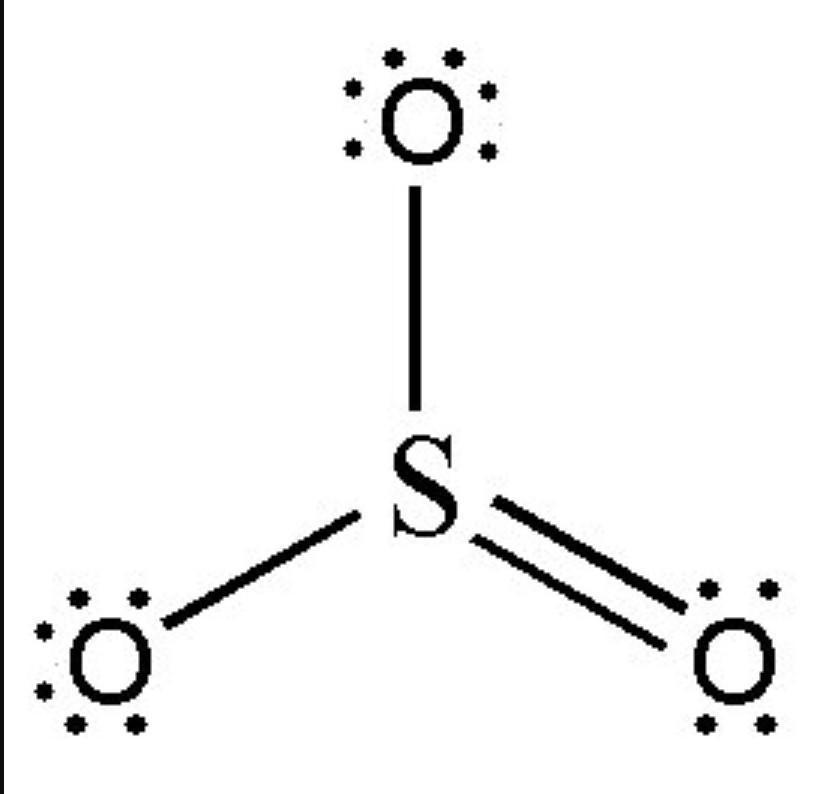 men då avviker ju den formella laddningen från 0 från varje atom, till skillnad från den lewisstruktur jag har ritat där alla atomer har 0 som formell laddning. Vad är rätt? Eller är det resonansstrukturer det handlar om?
men då avviker ju den formella laddningen från 0 från varje atom, till skillnad från den lewisstruktur jag har ritat där alla atomer har 0 som formell laddning. Vad är rätt? Eller är det resonansstrukturer det handlar om?
b. Jag har svårt att avgöra vilken som är lewissyra och lewisbas. Det jag vet är att lewisbaser avger elektroner och att lewissyror tar upp dessa så att det bildas en koordinerad kovalent bindning. Men hur ser jag vilket ämne som har avgett/upptagit elektroner?
Som du skriver, så handlar det om resonansstrukturer, så både du och facit har rätt. Som vanligt är engelska Wikipedia utmärkt:
Lewisbaser har ett fritt elektronpar, Lewissyror har en tom orbital som kan ta emot elektronparet. Hjälper detta dig att identifiera vilken som är vilken?
Men hur ser jag vilket ämne som har avgett/upptagit elektroner?
Var har det bildats en "ny" bindning?
Båda reaktanterna har ju fria elektronpar, men en av dem är en lewissyra och en är en lewisbas... Det är nog detta som förvirrar mig. Hur vet jag vilka fria elektronpar som kan avlägsnas?
Var har det bildats en "ny" bindning?
Den nya bindningen tänker jag har bildats mellan HO2 och S, eller?
Leta efter tomma orbitaler istället!
Hmm... Är det molekylorbitaler du menar?
Jag tänkte närmast på atomorbitaler, som en första enkel modell.
Svavel bör ha 1s2 2s2 2p6 3s2 3p4 och därmed 2 orbitaler som endast har 1 elektron var.
Syra bör ha 1s2 2s2 2p4 och därmed 2 orbitaler som endast har 1 elektron var.
Väte har 1s1 och därmed plats för en elektron till.
Men tomma orbitaler? Det förstår jag inte alls. Det finns väl hur många tomma orbitaler som helst "ovanför" de som är fulla/halvfulla.
Syre (inte syra, det är något annat) har inte några tomma eller halvtomma orbitaler, vad jag kan se, 8 elektroner i yttersta skalet överallt.
Svavel har inte tillräckligt många elektroner för att fylla alla sina orbitaler.
Jahaa, nu förstår jag nog vad du menade. Det jag skrev ovan var endast atomorbitalernas utseende när de är fria atomer (och hade skrivit fel på syre, sorry). Så det jag ska undersöka är elektronkonfigurationen utifrån de lewisstrukturer jag ritat?
De elektronerna i "inre" orbitaler räknas väl ej med eftersom dessa inte ingår i bindningen? Eller?
I så fall borde det bli:
syre: 2s2 2p6 (endast fulla)
väte: 1s2 (full)
svavel=3p4 (två halvtomma)
Det skulle alltså betyda att det ämnet som innehåller svavel är lewissyra -> SO3?
Jag kan inte hitta något annat som kan tänkas ta upp elekronpar, så jag skulle tro det.
Jag googlade lite på H2SO5, det verkar vara en riktigt ruskig kemikalie...
Hur blir det då med N2O och H2O, vilken är lewissyra och lewisbas där? Jag tycker inte att det finns tomma orbitaler någonstans...
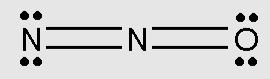
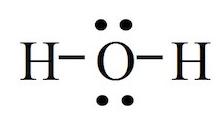
Gör en ny tråd för din nya fråga.



