Läsa av spektrofotometrisk diagram
Fråga 6. En lösning med kaliumpermanganat (KMnO4) av okänd koncentration späds genom pipettering av 20.0 mL av kaliumpermanganatlösningen ned i en bägare med 100 mL vatten. Vid en spektrofotometrisk analys av den utspädda lösningen uppmättes en absorbans på 0,325. Flera lösningar av kaliumpermanganat med olika koncentrationer förbereddes för kalibrering och presenterades i ett diagram enligt nedan. Beräkna den okända lösningens koncentration med hjälp av diagrammet.
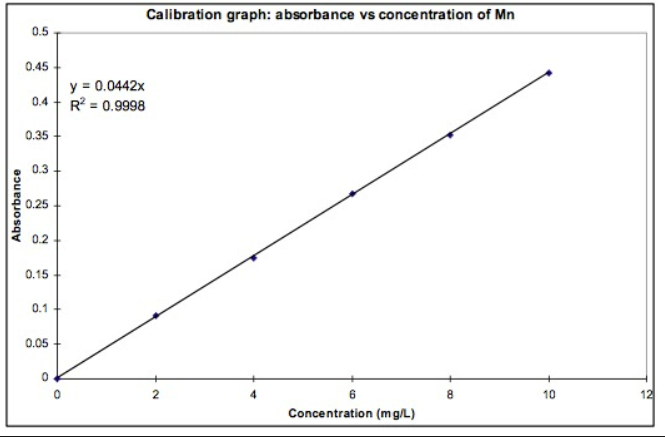
Min lösning:
Enligt kalibreringsgrafen har vi att y = absorbans, x = koncentration (mg/L)
y = 0.442x
Vid absorbans på (y) 0,325, får vi att x = 0.325/0.0442 ≈ 7.35 mg/L
eller: 4.65×10^−5 mol/L
Eftersom okända lösningen späddes 1:5 (20 mL i 100 mL), får vi att den okända lösningen blir 4.65×10^−5 mol/L * 5.
Jag undrar om denna avläsning av diagrammet och även uträkning stämmer, eftersom när jag skickade in svaret till läraren berättade hen för mig att "Utifrån diagrammet kan man se att en absorbans på 0,325 motsvarar en koncentration på ca 0,0375 mol/L". Hur fick läraren fram en koncentration på 0,0375 mol/L enligt diagrammet?
Din lärare har räknat om koncentrationsenheten i ditt diagram till mol/l, på så vis fås en annan enhet. Sedan har läraren antingen räknat ut koncentrationen (du har ju en rät linje så det går ganska enkelt), eller bara läst av i diagrammet.
Hej det jag inte förstår är när han säger att för absorbansen 0,325, så får han en koncentration på ca 0,0375 mol/L. När jag löser fram koncentrationen så får jag 7.35 mg/L och när jag gör om mg/L till mol/L så får jag fram det till 4.65×10^−5 mol. Varför får vi så markanta skillnader, läser vi av diagrammet på olika vis?
Lärarens lösning förstår jag inte alls, svaret verkar på tok för högt för att vara rimligt. Däremot är ditt svar också fel eftersom provet späds 6 och inte 5 gånger, notera att 20 ml blandas med 100 ml istället för att 20 ml spädes till 100 ml. Om koncentrationen i provet är 7,35 mg/L bör den vara 44,12 mg/L eller 0.04412 g/L i ursprungsprovet. Nästa fallgrop är att diagrammet visar koncentrationen av Mn och inte KMnO4. Delar man med molmassan för Mn får man svaret 8,0*10-4 mol/dm3.
Teraeagle skrev:Lärarens lösning förstår jag inte alls, svaret verkar på tok för högt för att vara rimligt. Däremot är ditt svar också fel eftersom provet späds 6 och inte 5 gånger, notera att 20 ml blandas med 100 ml istället för att 20 ml spädes till 100 ml. Om koncentrationen i provet är 7,35 mg/L bör den vara 44,12 mg/L eller 0.04412 g/L i ursprungsprovet. Nästa fallgrop är att diagrammet visar koncentrationen av Mn och inte KMnO4. Delar man med molmassan för Mn får man svaret 8,0*10-4 mol/dm3.
Jaha, missade att den blandades, tack! Så som jag förstått rätt så är den ursprungliga koncentrationen 8,0*10-4 mol/dm3. Även om man bara dividerar med Mn molmassa för att få ut koncentrationen Mn. Detta på grund av för varje Mn finns en molekyl KMnO4? Om jag har förstått det rätt 😅
Ja precis, men KMnO4 är inte en molekyl utan ett salt. (Rätt begrepp är formelenhet, dvs det finns en Mn för varje formelenhet KMnO4).
Teraeagle skrev:Ja precis, men KMnO4 är inte en molekyl utan ett salt. (Rätt begrepp är formelenhet, dvs det finns en Mn för varje formelenhet KMnO4).
Då vet jag, tack så mycket!


