Labration: Syntes av paracetamol
Hej!
Vi har genomfört en laboration i skolen som gick ut på att skapa paracetamol (alvedon) med hjälp av p-aminofenol, ättiksyraanhydrid och natriumacetat 5 M. Ämnena blandades och omrördes. Därefter kyldes lösningen ner i isbad. För att få ut innehållet sugfiltrerades lösningen m.h.a. en nüchnertratt och filterpapper. Pulvret vi fick ut gav ett svagt utslag på TLC-plattan som användes som kontroll efteråt.
Vi ska nu skriva en labbrapport på detta och jag tror jag har fått ut rätt reakrionsformel:
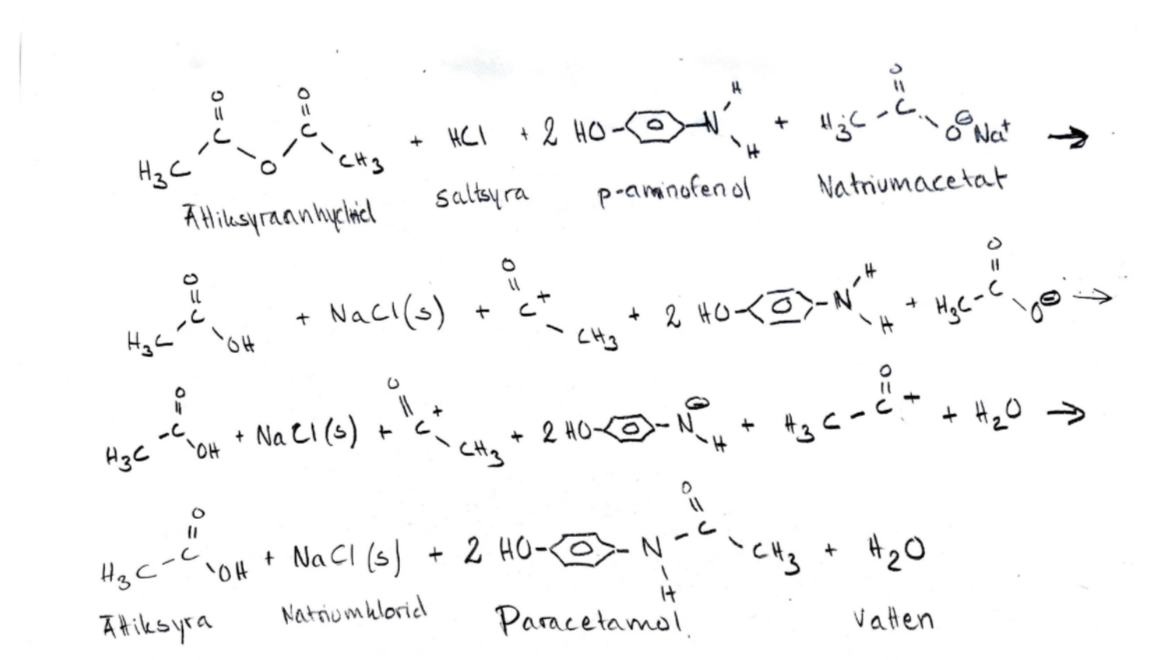
2 p-aminofenol + ättiksyraanhydrid → 2 paracetamol + ättiksyra
2C6H7NO + C4H6O3 --> 2C8H9NO2+ CH3COOH
Det jag skulle vilja ha hjälp med är följande frågeställning som jag fått av min lärare:
"Vilken egenskap hos aminogruppen gör att kondensationsreaktioner sker just där?"
Jag förstår hur molekylerna binder till varandra men har svårt att koppla det till en kondensationsreaktion? Eller vad som påverkar att reaktionen sker just där? Är det att ett väte frigörs när de bind men kan det kalls för kondensationsreaktion?
Mvh.
Elsa
Det blir nog enklare att diskutera efter att du först undersökt (boken/google/wiki...) hur kondensationsreaktioner kan ske. Och även funderat över vilka funktionella grupper som kan tänkas vara inblandade i just den kondensationsreaktion du gjort.
Om du fastnar i undersökandet, eller får frågor om denna reaktion är du så klart välkommen att fråga här! Även med andra frågor om syntesen.
Okey har läst på lite nu och funderat på det lite och kom på lite gamla grejer med elektronegativitet :)
Syret är mer elektronegativ än kvävet vilket gör att vätet hellre vill binda till syret. Det gör att syret släpper då ättiksyraanhydrid och binder till två väte och bildar då vatten (kondensationsreaktion). Nu bildas två positivt laddade molekyler 2C2H3O+ som dras till den negativt laddade p-aminfenolet som tappat ett väte. En av de positivt laddade molekylerna binds då till det negativt laddade p-aminofenolet och bildar paracetamol.
Elektronegativiteten är viktig inom en molekyl, men du har två olika molekyler som reagerar. Och några positivt laddade joner, likt de du nämnde, bildas inte under denna syntes (de är dessutom allt för reaktiva för att inte reagera med något annat direkt, och då bildas inte paracetamol utan något annat).
En typ av kondensationsreaktion som finns beskriven i din kemibok är bildandet av en ester (mellan en alkohol och en karboxylsyra), och denna reaktion är lik den som sker i din syntes.
Ta och titta på hur en kondensationsreaktion sker istället (på nätet, bl.a. engelska wiki har det definitivt), så går det lättare att förstå varför:
1)
hur kondensationsreaktionen sker, vilket hjälper till att förklara:
2)
"Vilken egenskap hos aminogruppen gör att kondensationsreaktioner sker just där?"
Fastnar du på kondensationsreaktionen sker, kan du så klart fråga.
Jah! Kollade på en esterreaktion. HCl fungerar som en katalysator för att en karbokattjon ska kunna skapas. HCl protolyseras och ger en väte till ätiksyraanhydriden som syret binder till vilket gör att kolen blir mer positivt laddade. HCl behövs alltså för att göra skillnaden i laddning större (attraktionskraften). Är jag på rätt väg?
Får dock inte ihop hur reaktionen ska gå. Det som förvirrar mig är på vilket syre vätet från HCl kommer binda. 
Jag var kanske inte tydlig nog tidigare, men det kan inte bildas en fri karbokatjon så som du ritat (bl.a. med motivationen att den lämnande gruppen inte tillräckligt bra för detta, en positiv laddning kan inte lagras på karbonylkolet, och skulle en karbokatjon bildas skulle kloridjonen anfalla denna och skapa en bindning, om inte en vattenmolekyl hinner före).
Karbokatjoner är generellt extremt reaktiva, och behöver speciella omständigheter för att bildas, och ofta stabiliseras för att "överleva" tillräckligt länge för att den önskade reaktionen skall ske (och inte massa andra reaktioner istället).
Om vi nu helt bortser ifrån bildandet av några fria joner (oavsett typ), så kan vi titta på en kondensationsreaktion som den klassiska Fischer esterifieringen i bilden nedan, där karboxylsyragruppen binder en proton (överst) och skapar en stabiliserad karbokatjon (de tre formerna inom klammrarna stabiliserar den positiva laddningen). Sedan anfalls karbokatjonen av ett fritt elektronpar från alkoholen.

Och i slutändan bryts bindningen mellan ättiksyraenheterna i ättiksyraanhydriden, och paracetamol samt ättiksyra bildas.
Flyttar den positiva laddningen mellan tre tre inom klammrarna eller är det tre olika utfall av karbokatjoner som kan bildas? Stabiliseras krabokatjonen när den byter mellan formerna eller när det tillkommer ett nytt ämne?
Har ritat upp hela reaktionen men hur ska jag rita om karbokatjonerna inte får vara fria?
Får man inte skriva fria karbokatjoner i reaktioner? Även om de bara sker i en kort kort stund?
Elsaschuttler skrev:Flyttar den positiva laddningen mellan tre tre inom klammrarna eller är det tre olika utfall av karbokatjoner som kan bildas? Stabiliseras krabokatjonen när den byter mellan formerna eller när det tillkommer ett nytt ämne?
Att det finns tre olika former, som dessa resonansformer, är det som stabiliserar den positiva laddningen (karbokatjon är den endast när den positiva laddningen finns på kolet, finns laddningen på ett av syreatomerna är det ingen karbokatjon, men det är med karbokatjonformen som reaktionen sker. Att de andra två formerna finns ökar tiden som karbokatjonen finns, och därmed ökar chansen att rekationen sker, för bildas endast karbokatjonformen reagerar den t.ex. med kloridjonen/vatten om tillfälle ges. Resonansstabiliseringen saktar ner reaktionen, så att fram för allt estern bildas).
Elsaschuttler skrev:Får man inte skriva fria karbokatjoner i reaktioner? Även om de bara sker i en kort kort stund?
Jo det går att skriva ut dem, t.ex. vid (E1) eliminationsreaktioner bildas en karbokatjon, och bildandet av denna karbokatjon begränsar reaktionens hastighet, så den karbokatjonen brukar ofta skrivas ut.
Men i denna reaktion är karbokatjonen en av tre former som kan finnas, och dessa former ändras hela tiden fram och tillbaka, så det går inte riktigt att beskriva vilken form som finns vid ett tillfälle - istället anges alla tre, och vi får anta att vi endast kan beskriva att samtliga finns till viss del representerade. D.v.s. att det är ungefär lika sannolikt att de tre olika formerna att finnas vid ett specifikt tillfälle, eller att det är 1/3 sannolikhet att just en form finns vid detta specifika tillfälle. Men det spelar inte så stor roll, då endast en av dem (karbokatjonen) reagerar. Det viktiga är att de två andra formerna kan finnas, och på så vis resonansstabilisera karbokatjonen.
Elsaschuttler skrev:Har ritat upp hela reaktionen men hur ska jag rita om karbokatjonerna inte får vara fria?
Nej denna form av karbokatjonen bildas inte i denna reaktion (och skulle den bildas, skulle den reagera för snabbt för att bilda den produkt du söker, paracetamolen).
Istället sker detta, som påminner om en kondensationsreaktion, även om det inte är vatten som bildas som restprodukt (som sker vid kondensationsreaktioner) utan istället bildas ättiksyra.

Aminogruppen (NH2) i p-nitrofenolen är den som skapar en ny bindning till en av kolatomerna i ättiksyraanhydriden (som är deltapositiv, eftersom syreatomerna bredvid kolatomen drar åt sig elektronerna).
Kommer du närmare ett svar på din fråga?
Vilken egenskap hos aminogruppen gör att kondensationsreaktioner sker just där?
Att reaktionen sker just där beror på de aminogruppens egenskaper, samt ättiksyraanhydridens egenskaper (kanske lite kryptiskt men kommer du inte vidare efter lite funderande så fortsätter vi).
Tack så jätte mycket! Ska försöka få ihop allt tillsammans under dagen :D.
För all del. Återkom om du fastnar.
Okey nu kom det mer frågor.
När ätiksyraanhydriden delat sig och vi får C2H3O, var kommer då protonen att binda och blir de tre olika utfallen som karbokatjoner positiv laddning på C, C, O?
Om vätet från HCl binder till syret så kan utfalla vara med och utan dubbelbindning men om för att få karbokatjon på O och C (kolet i mitten), men om andra C också ska kunna vara positivt laddad i ett annat utfall så får jag inte ihop det med bindningar...
Menade positiv laddning när jag skrev karbokatjon
Elsaschuttler skrev:Okey nu kom det mer frågor.
När ätiksyraanhydriden delat sig och vi får C2H3O,
var kommer då protonen att binda och blir de tre olika utfallen som karbokatjoner positiv laddning på C, C, O?
Jag förstår inte riktigt vad du menar här
Aminogruppen (-NH2) bildar en bindning till ättiksyraanhydriden (vänster upp), och sedan omlagras elektronerna (höger uppe, det är vad de börja pilarna visar) så dubbelbindningen mellan syre och kol återskapas, samtidigt som bindningen från detta kol till syret bryts.
En karbokatjon kan anses finnas på kolatomen i ättiksyraanhydriden (den som aminogruppen anfaller ). Och detta som en resonasstabiliserad form av ättiksyraanhydriden. Det finns med andra ord ingen stabil karbokatjon, som kan "ses", Utan att kolatomen (som anfalls av aminogruppen) har delvis en positiv laddning under en väldigt kort tid är det en karbokatjon, sedan blir den oladdad, sedan börjar det om igen. Att dubbelbindningen mellan detta kol och syret (C=O) ibland blir en enkelbindning (för att elektronerna hoppar upp på syret) en liten stund, förklarar varför elektronerna i aminogruppen så gärna skapar en ny enkelbindning till denna kolatom.
Om vätet från HCl binder till syret så kan utfalla vara med och utan dubbelbindning men om för att få karbokatjon på O och C (kolet i mitten), men om andra C också ska kunna vara positivt laddad i ett annat utfall så får jag inte ihop det med bindningar...
Det kan även beskrivas som att den nya bindningen (från aminogruppen) pressar upp två av elektronerna från dubbelbindningen till syret. Och när dessa två elektroner hoppar ner igen, och återskapar dubbelbindningen, sparkas bindningselektronerna mellan kolet och -OCOCH3 bort, och paracetamol och en acetatjon bildas.
hmm okey. Binder p-aminofenolet till ätiksyraandehyden samtidigt som syrets tar tillbaka sina elektroner och dubbelbindingen blir en enklelbindning? För dubbelbindningen bordet väl brytas först för annars kan inte kolet bli positivt laddad och då kan inte p-aminofenolet attraheras. Men hur kan bara dubbelbindningen brytas utan anledning då. Eller har det med att en väte protolyseras från saltsyran som sätter igång reaktionen men var binds vätet då? Likt efterbildningarna. Det är min tankegång just nu.
Pratade också med min lärare idag och kan sa att det troligast skulle bilda vatten och inte ättiksyra, vilket gjorde med ännu mer förvirrad. Han kan ha tagit fel men vad är det som gör att det ättiksyra och inte H2O? För när bindningen i mellan forna ättiksyaanhydrigen bryts (C-O) så får ju syret en mindre elektron och måste då bli positivt laddat under en kort kort period, men syret måste j vara negativt om det ska attrahera en elektron? Känns som jag har rört till det nu.
attrahera en väte (proton), inte elektron*
Elsaschuttler skrev:hmm okey. Binder p-aminofenolet till ätiksyraandehyden samtidigt som syrets tar tillbaka sina elektroner och dubbelbindingen blir en enklelbindning? För dubbelbindningen bordet väl brytas först för annars kan inte kolet bli positivt laddad och då kan inte p-aminofenolet attraheras.
Precis hur det går till beror på hur detaljerat man tycker det behöver vara. Vid organisk syntes är fokus oftare på hur reaktionen sker, vilket visas med de bågpilarna. Dessa pilar visar vilka (bindnings)elektroner som flyttas runt och deltar i form av fria elektronpar eller som skapande en kovalent (dubbel)bindning.
För teoretiska kemister är förklaringen med den resonansstabiliserade karbokatjonformen, kanske mer intressant än själva syntesen av paracetamol.
För att förklara att reaktionen sker kan den resonansstabiliserade karbokatjonen användas, men denna karbokatjon är svår att observera (men det kanske går). Dock är detta en aningen förenklad förklaring av vad som sker (den mer detaljerade modellen för detta kräver kunskaper om orbitaler och kvantkemi, men det dyker först upp på kemikurser på universitet).
Men hur kan bara dubbelbindningen brytas utan anledning då. Eller har det med att en väte protolyseras från saltsyran som sätter igång reaktionen men var binds vätet då? Likt efterbildningarna. Det är min tankegång just nu.
Du kan tänka dig att en vätejon binder mellan syreatomerna (karbonylsyreatomerna). Och ömsom finns den positiva laddningen på syreatomerna, och ömsom på kolatomerna. När protonen binds, uppstår en positiv laddning (eftersom bägge elektronerna som behövs för att skapa bindningen till protonen lånas ut av syreatomen, och då blir det en elektron för lite, d.v.s. laddningen plus ett).
Denna positiva laddning kan då enkelt resonansstabiliseras ("hoppa runt") i ättiksyraanhydriden, genom att ett elektronpar kan flyttas från en dubbelbindning till en syreatom, och sedan tillbaka till dubbelbindningen:

Elsaschuttler skrev:Pratade också med min lärare idag och kan sa att det troligast skulle bilda vatten och inte ättiksyra, vilket gjorde med ännu mer förvirrad. Han kan ha tagit fel men vad är det som gör att det ättiksyra och inte H2O? För när bindningen i mellan forna ättiksyaanhydrigen bryts (C-O) så får ju syret en mindre elektron och måste då bli positivt laddat under en kort kort period, men syret måste j vara negativt om det ska attrahera en elektron? Känns som jag har rört till det nu.
Det kan inte bildas vatten från ättiksyraanhydriden, utan det bildas ättiksyra.
En anhydrid är vad som bildas om två karboxylsyror kondenseras. Ättiksyraanhydriden är i princip två ihopsatta molekyler av ättiksyra, minus en vattenmolekyl (som i bilden nedan). Det kanske var det som din lärare strulade till.

Polletten har trillat ner för resonansstabiliseringen, tror jag behövde se det visuellt, tack! Så ska släppa att gå in djupare på den även fast jag tycker om att grotta ner mig i saker ;)
Ska be min lärare kolla igenom det igen och har nu ett bra argument till det. Fick inte ihop det efter han sa det och fick nu det bekräftat att det inte kan vara fallet. Tack!
Tror min lärare tänkte att syret (med enkelbindningen) bildar vatten medans de två kvarvarande delarna av ättiksyraanhydriden bilder varsin paracetaol med varsin p-aminofenol.
ätiksyraanhydrid + 2p-aminofenol - - > 2paracetamol + vatten.
Men då menar du att vattnet inte kommer kunna finnas då en utav ättiksyraanhydriden direkt tar upp det och bildar ättiksyra?
Min lärare erkände sittt fel och höll med att det bildas ättiksyra!
Elsaschuttler skrev:Tror min lärare tänkte att syret (med enkelbindningen) bildar vatten medans de två kvarvarande delarna av ättiksyraanhydriden bilder varsin paracetaol med varsin p-aminofenol.
ätiksyraanhydrid + 2p-aminofenol - - > 2paracetamol + vatten.
Men då menar du att vattnet inte kommer kunna finnas då en utav ättiksyraanhydriden direkt tar upp det och bildar ättiksyra?
Vatten kommer inte kunna bildas från ättiksyraanhydriden var vad jag menade, inte med denna typ av kemiska reaktioner i alla fall. (Bränner du istället ättiksyraanhydriden i luft så bildas vatten och koldioxid, men det är en helt annat typ av reaktion).
Jag har sammanställt i min rapport nu men börjar tveka på om det är SN1 eller SN2 reaktion? Hade tillsammans med ett gäng kompisar kommit fram till att det var en SN1 men nu när jag ska skriva som det känns det fel... Måste inte p-aminofenolet först binda till ätiksyraanhydridet innan enkelbindningen mellan kolet och syret kan brytas? För hur annars kan bindningen brytas om den inte påverkas av p-aminofenolet? Har i så fall ingen förklaring på det.
Vid en SN1 reaktioner sker oftare när kolatomen som anfalls inte är direkt åtkomlig för den attackerande atomen (t.ex. när det finns andra atomer som "skymmer" kolatomen. Men med denna reaktion ni har kan kolatomen attackeras direkt av det fria elektronparet från aminogruppen. Vid en SN1 reaktion krävs en bra lämnande grupp (t.ex. en halogen som en kloridjon, men det saknas i dina reaktanter), som när den lämnar ger upphov till en karbokatjon, men det kan inte ske vid denna reaktion.
Så din tanke stämmer bra, d.v.s att p-nitrofenolens aminogrupp först behöver binda till kolet, innan bindningen till syret i ättiksyraanhydriden bryts. Så då blir reaktionen en.....
Det blir en SN2 reaktion!
Men under resonansstabiliseringen bildas det väl karbokatjoner, två av de fyra olika möjliga laddningförflyttningarna (när elektronparet hoppar runt) är vid kolatomer. Varför kallas inte de för karbokatjoner?
I våran labbrationsbeskrivning står det att det bildas en SN1 reaktion. Nu vet jag inte riktigt var jag ska ställa mig...
I våran labbrationsbeskrivning står det att det bildas en SN1 reaktion. Nu vet jag inte riktigt var jag ska ställa mig...
Det var illa i så fall. Det är nog hög tid att uppdatera laborationsinstruktionerna. Motsvarande finns på t.ex. engelska på nätet, om skolan behöver inspiration.
Nu till vad som sker under din reaktion.
Det bildas en resonsansform av ättiksyraanhydriden, som motsvarar en karbokatjon (inlägg #22), men den bildas och försvinner hela tiden. Grundformen av ättiksyraanhydriden kan bildas igen. Denna resonansform motsvarar inte riktigt en "fri" eller "isolerad" karbokatjon, utan är endast en av många möjliga former som ättiksyraanhydriden kan finnas i.
En SN1 reaktion sker i två steg:
1) en karbokatjon bildas, när en grupp lämnar i reaktionens första steg (och denna bildning är begränsande för reaktionens hastighet). En sådan bra lämnande grupp saknas i ättiksyraanhydriden.
2) I det andra steget anfaller en nukleofil denna bildade karbokatjon
Så vid SN1 reaktioner sker det två steg för att bilda den nya bindningen mellan de två molekylerna motsvarande, genom att en bindning bryts och efter det bildas en ny.

sedan

Men vid denna reaktion bildas bindningen, mellan p-nitrofenol och kolatomen i ättiksyraanhydriden, samtidigt som en av dubbelbindningarna till syret bryts. Och att en ny bindning skapas samtidigt som en befintligt bryts är det som utmärker en SN2 reaktion.
Resonansstabiliseringen sker samtidigt som p-aminofenolet binds till ätriksyraanhydriden? Det sker när resonansstabliliseringen när kolet råkar vara negativt laddat (under den kort stunden) som allt sker samtidigt (dubbelbindningen bryts så kolet blir delta positivt samtidigt som p-aminofenolet då direkt dras och binder till ätiksyraanhydriet och sedan lämnar ättiksyran som ska bildas) . Man tänker ofta inte på att reaktionerna sker mycket snabbare än man tror.
I mitt tycke ligger väldigt mycket av denna diskussion klart över nivån för Kemi 2, snarare något motsvarande introduktionen till organisk kemi på universitetsnivå. Men det är så klart kul att prata kemi ändå, även om det kanske blir lite mer utmanande. Så det är bra att du frågar mer när det inte är klart för din del.
Elsaschuttler skrev:Resonansstabiliseringen sker samtidigt som p-aminofenolet binds till ätriksyraanhydriden? Det sker när resonansstabliliseringen när kolet råkar vara negativt laddat (under den kort stunden) som allt sker samtidigt (dubbelbindningen bryts så kolet blir delta positivt samtidigt som p-aminofenolet då direkt dras och binder till ätiksyraanhydriet och sedan lämnar ättiksyran som ska bildas) . Man tänker ofta inte på att reaktionerna sker mycket snabbare än man tror.
I fall som detta kan man inte veta precis hur det ser ut för en molekyl, utan man kan beskriva det som att en genomsnittsmolekyl kan finnas i flera tillstånd (med en sannolikhetsfördelning mellan tillstånden). Där ett av dessa tillstånd (med positiv laddning på kolatomen, motsvarande en karbokatjon) som är mest benägen att acceptera den nya bindningen. Så i princip spelar det inte någon roll vilken fördelningen är, då molekyler byter mellan formerna så snabbt.
Så om vi tittar på ett antal ättiksyranhydridmolekyler, kommer det hela tiden vara en fördelning mellan de olika tillstånden. Elektronparen som hoppar runt i ättiksyranhydriden gör detta hela tiden, och det går ruskigt snabbt, precis som du skrev. Jag vet inte ens om det går att mäta och se dessa olika tillstånd (misstänker att det inte går alls, men man kan så klart beräkna detta, men du vill ju syntetisera något så dessa beräkningar är inte riktigt intressanta).
Bildandet av den nya bindningen sker lättast när kolatomen är positiv (och då bildas bindningen väldigt lätt, negativa elektroner söker sig väldigt gärna till det positiva kolet). Så bland ett antal ättiksyranhydridmolekyler reagerar endast det fåtalet molekyler som har positivt kol, vid en tidpunkt. Och över laborationens tid hinner teoretiskt att reagera.
Vid beskrivningar av liknande reaktioner sammanfattas ofta laddningsförskjutningarna i molekylerna, förenklat, som att kolatomen är deltapositiv och syreatomen (med bunden proton) är deltanegativ. Och aminogruppens fria elektronpar söker sig därför till den deltapositiva kolatomen.
Hoppas det blev lite klarare.
Ja nu har alla frågor fått svar! Tack för alla svar, har uppskattats väldigt mycket med tanke på missvisande resonemang från lärare. Tycker det är roligt att dyka djupt i en sak även fast det kan vara bortom min tidigare kunskap och kursens nivå. Gör kemin lite roligare :)

