Laboration 1
Hej! Jag har fått i uppdrag att utföra en hemlaboration som jag behöver lämna in.
Salter kan framställas på flera sätt. De vanligaste är att metall och syra, metalloxid och syra eller och metallhydroxid får reagera med varandra. Av säkerhetsskäl måste du använda en lite annorlunda metod, men principen för saltframställningen är densamma som i exemplen ovan.
Material•12-procetig ättiksprit (finns i handeln)
•Bakpulver (natriumvätekarbonat)Utförande:
1.Häll en matsked (15 ml) ättiksprit i ett decilitermått. Späd med kranvatten till 1 dl. Tillsätt 2 strukna teskedar bakpulver.
2.Rör om. Vänta till dess att gasutvecklingen tar slut.
3.Filtrerar lösningen genom ett kaffefilter.
4.Häll den filtrerade lösningen i en skål med stor botten.
5.Ställ skålen på en torr och varm plats. Låt skålen stå så länge att lösningen avdunstar (vätskan försvinner) och kristallerna träder fram. Det tar kanske ett dygn. Studera kristallerna.
6.Fotografera ditt resultat (lägg din legitimation jämte din bägare).Så här kan resultatet bli om man använder en efterrättsskål eller pajform av glas för indunstningen.
Jag har följt anvisningarna ovan och väntar på att vattnet ska avdunsta. Jag funderar på hur jag ska skriva reaktionsformeln och hade behövt hjälp med detta. Tacksam för svar
CH₃COOH+NaHCO₃+H2O
En bra beskrivning av experimentet!
Du behöver för din reaktionsformel också reaktionsprodukter som uppstå.
För att får en ide:
Läs också om kolsyra vad som är så speciellt med den.
Till slut kan du ställa upp hela ekvationen. :)
CH₃COOH+NaHCO₃+H2O →CH3COO-+H3O++NaHCO3+CO2
Fattar inte riktigt hur jag ska göra, men jag har läst igenom länken du skickade och läst lite om kolsyra.
Ättikspriten är en svag syra och bakpulvret är basiskt. Dom reagerar alltså och det skapas en kemisk reaktion när dom reagerar (kolsyra). När kolsyran (gasform) försvinner ifrån glaset så återstår det alltså salter? Varför använde jag filter? Jag fattar ingenting, tacksam för hjälp :)
Hmm, det som bubblar är koldioxid gas som frigörs. Det borde finnas i din ekvation på produktsidan.
Du har några delprocesser som du kan formulera separat för att förstå det hela bättre. Om du vill kan du sammanfatta det till slut till en hel ekvation.
1a) Först som en "empiriskt regel" som man bara måste lära sig:
"En stark syra tränger en svag syra från sina salter." *
Det baserar på att en stark syra har en högre tendens att avger sitt H+.
Delreaktionen blir därmed
CH₃COOH + NaHCO₃ → Na+CH3COO- + H2CO3
För din laboration kan du gärna skriva pKs värden för ättika och kolsyra här för att visa.
1b) Kolsyra är inte stabil och det bildas _
Det har du ju läst... :)
1c) Sedan kan du formulera en komplett reaktionsekvation för att fortsätta i din laboration.
2) För att fungera som CO2 källa behövs det bara bikarbonat, men i bakpulver finns mer substanser
- salter av andra syror. Varför det?
- ...
Mer info här
https://sv.wikipedia.org/wiki/Bakpulver
Kul, det blir spännande att se din foto av resultatet! :)
Vad är det då för kristaller?
*
"En stark syra tränger en svag syra från sina salter." Kanske någon har en snyggare formulering?
Om man funderar lite mer, så kan man det också beskriva som en syra/bas reaktion.
Zockimon skrev:Hmm, det som bubblar är koldioxid gas som frigörs. Det borde finnas i din ekvation på produktsidan.
Du har några delprocesser som du kan formulera separat för att förstå det hela bättre. Om du vill kan du sammanfatta det till slut till en hel ekvation.
1a) Först som en "empiriskt regel" som man bara måste lära sig:
"En stark syra tränger en svag syra från sina salter." *Det baserar på att en stark syra har en högre tendens att avger sitt H+.
Delreaktionen blir därmedCH₃COOH + NaHCO₃ → Na+CH3COO- + H2CO3
För din laboration kan du gärna skriva pKs värden för ättika och kolsyra här för att visa.
1b) Kolsyra är inte stabil och det bildas _
Det har du ju läst... :)1c) Sedan kan du formulera en komplett reaktionsekvation för att fortsätta i din laboration.
2) För att fungera som CO2 källa behövs det bara bikarbonat, men i bakpulver finns mer substanser- salter av andra syror. Varför det?
- ...
Mer info härhttps://sv.wikipedia.org/wiki/Bakpulver
Kul, det blir spännande att se din foto av resultatet! :)
Vad är det då för kristaller?
*
"En stark syra tränger en svag syra från sina salter." Kanske någon har en snyggare formulering?
Om man funderar lite mer, så kan man det också beskriva som en syra/bas reaktion.
Men ättiksprit är väl en svag syra? Bakpulvret som innehåller natriumkarbonat är basiskt eller? Är det meningen att jag ska få fram att Ättikan(CH₃COOH) reagerar med natriumkarbonat (NaHCO₃) och detta leder till att det bildas koldioxid(CO2)som försvinner ifrån glaset i gasform. När vattnet(H2O) avdunstar så återstår då alltså Natrium(Na) eller?
Tack för ett utförligt svar, försöker greppa detta!
1. Sök fram pKs värden av ättika och kolsyra, jämför och titta vilken är starkare.
Stark och svag är relativ. Kanske bättre att formulera
"Den starkare syra tränger den svagare syra från sina salter."
2. 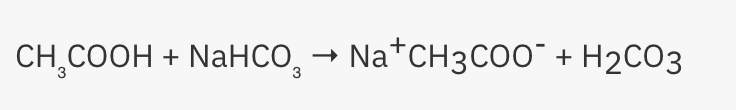 Det här är reaktionen som händer i första steget.
Det här är reaktionen som händer i första steget.
Sedan bubblar koldioxid ut, vattnet avdunstar över natt. Vad är kvar?
(Och som kommentar: Aldrig!! Verkligen aldrig misstar Na som element och metall med Na+ vilket är en jon som inte existerar för sig ensamt men alltid är tillsammans med en anjon i närheten. Som salt har natrium helt annorlunda egenskaper som det högt reaktiva metall natrium.)
Så, vad är kvar?
Bakpulver innehåller natriumvätekarbonat, inte natriumkarbonat.
Zockimon skrev:1. Sök fram pKs värden av ättika och kolsyra, jämför och titta vilken är starkare.
Stark och svag är relativ. Kanske bättre att formulera
"Den starkare syra tränger den svagare syra från sina salter."
2.Det här är reaktionen som händer i första steget.
Sedan bubblar koldioxid ut, vattnet avdunstar över natt. Vad är kvar?
(Och som kommentar: Aldrig!! Verkligen aldrig misstar Na som element och metall med Na+ vilket är en jon som inte existerar för sig ensamt men alltid är tillsammans med en anjon i närheten. Som salt har natrium helt annorlunda egenskaper som det högt reaktiva metall natrium.)
Så, vad är kvar?
Ok, jag kollar upp syrakonstanten för ättika och kolsyra. Ättikas pK är 4.74 och kolsyras pK är 6.35. Alltså är kolsyrans pK större än ättikans.
Bakpulver innehåller koldioxid och är basiskt, när det reagerar med ättika som är en svag syra så separeras koldioxiden som blir kolsyra i vattnet och lämnar sedan glaset i gasform. Vattnet avdunstar under natten och då tänker jag såhär typ?
CH₃COOH + NaHCO₃ → Na+CH3COO- + H2CO3
Na+CH3COO- + H2CO3 → Na+CH3COO
Såhär eller? Eftersom att H2CO3 försvinner va?
1. Helt rätt att till slut natriumacetat bara är kvar.
Det är dock viktigt att förstå vad man skriver.
Na+CH3COO- med + och - som små tecken lite högre upp liksom matematiska exponenter beskriver en laddning på en jon.
Därmed är Na+CH3COO- en tydligt beskriven jonförbindelse, en salt
Man kunde teoretiskt förkorta det till NaCH3COO, men då är det för nybörjare inte så lätt att se att det är en jonförbindelse. När man är mer erfaren, så vet man det automatisk och kan använda korta formen)
Liksom NaHCO₃ är korta versionen av Na+HCO₃ -
Och det är absolut inte detsamma än Na+CH3COO, vilket är något som låter ställa upp mina (kemisk tänkande) hår....,
eftersom det vore elementar natrium (ytterst reaktiv) och en ofullständig molekylformel, i värsta fall en så kallad radikal vilket är en kortvarig och likadan ytterst reaktiv mellanstadium.
Jag hoppas du kan se att det är viktigt att vara mycket noggrann med vad de enskilda plus tecken betyder här.
Delekvation 1 syra bas reaktion av ättika och natriumvätecarbonat
CH₃COOH + NaHCO₃ → Na+CH3COO- + H2CO3
Delekvation 2 dissociation kolsyra
Gör ett försök här (du kan kolla det på nätet.)
2.
"Ok, jag kollar upp syrakonstanten för ättika och kolsyra. Ättikas pK är 4.74 och kolsyras pK är 6.35. Alltså är kolsyrans pK större än ättikans."
Ja, och vad betyder det? Vilken syra är starkare?
Zockimon skrev:1. Helt rätt att till slut natriumacetat bara är kvar.
Det är dock viktigt att förstå vad man skriver.
Na+CH3COO- med + och - som små tecken lite högre upp liksom matematiska exponenter beskriver en laddning på en jon.Därmed är Na+CH3COO- en tydligt beskriven jonförbindelse, en salt
Man kunde teoretiskt förkorta det till NaCH3COO, men då är det för nybörjare inte så lätt att se att det är en jonförbindelse. När man är mer erfaren, så vet man det automatisk och kan använda korta formen)
Liksom NaHCO₃ är korta versionen av Na+HCO₃ -
Och det är absolut inte detsamma än Na+CH3COO, vilket är något som låter ställa upp mina (kemisk tänkande) hår....,
eftersom det vore elementar natrium (ytterst reaktiv) och en ofullständig molekylformel, i värsta fall en så kallad radikal vilket är en kortvarig och likadan ytterst reaktiv mellanstadium.
Jag hoppas du kan se att det är viktigt att vara mycket noggrann med vad de enskilda plus tecken betyder här.
Delekvation 1 syra bas reaktion av ättika och natriumvätecarbonatCH₃COOH + NaHCO₃ → Na+CH3COO- + H2CO3
Delekvation 2 dissociation kolsyra
Gör ett försök här (du kan kolla det på nätet.)
2."Ok, jag kollar upp syrakonstanten för ättika och kolsyra. Ättikas pK är 4.74 och kolsyras pK är 6.35. Alltså är kolsyrans pK större än ättikans."
Ja, och vad betyder det? Vilken syra är starkare?
1. Delekvation 1 syra bas reaktion av ättika och natriumvätecarbonat
CH₃COOH + NaHCO₃ → Na+CH3COO- + H2CO3
Delekvation 2 dissociation kolsyra
H2CO3HCO3-+H+
2. Detta innebär väl att kolsyran är en starkare syra, va? Eftersom att syrakonstanten är starkare väl? :)
A) Delekvation 2 dissociation kolsyra
Kanske mitt fel att inte vara tydlig, jag menade den här som ger.... koldioxid! :)
H2CO3 → CO2 +H2O
Hur blir då hela kemiska ekvationen i bubbeldelen av experimentet?
(Du behöver bara ersätta kolsyra i delekvation 2 med något som bubblar.)
B) "2. Detta innebär väl att kolsyran är en starkare syra, va? Eftersom att syrakonstanten är starkare väl? :)"
Nej
pKs är den negativa dekadiska logarytmus av jämnviktskoncentrationerna. Så det är precis tvärtom. Desto större pKs är, desto svagare är syran. Kolla gärna pKs av saltsyra eller svavelsyra.
C) Har du en bild av dina kristaller?
Zockimon skrev:A) Delekvation 2 dissociation kolsyra
Kanske mitt fel att inte vara tydlig, jag menade den här som ger.... koldioxid! :)
H2CO3 → CO2 +H2O
Hur blir då hela kemiska ekvationen i bubbeldelen av experimentet?
(Du behöver bara ersätta kolsyra i delekvation 2 med något som bubblar.)
B) "2. Detta innebär väl att kolsyran är en starkare syra, va? Eftersom att syrakonstanten är starkare väl? :)"
Nej
pKs är den negativa dekadiska logarytmus av jämnviktskoncentrationerna. Så det är precis tvärtom. Desto större pKs är, desto svagare är syran. Kolla gärna pKs av saltsyra eller svavelsyra.
C) Har du en bild av dina kristaller?
Då kan jag skriva såhär, va?
CH₃COOH + NaHCO₃ → CO2 +H2O
Så ättikan är en starkare syra än kolsyra
 Här är en bild på experimentet.
Här är en bild på experimentet.
Tack för ditt tålamod :)
Tack för bilden, vad spännande! :)
A) Angående reaktionen... Det saknas något.
Som en enkel regel vid stökiometriska kemiska formler måste alltid antal atomer på vänster sidan vara lika stor som på höger sidan.
Man kan inte trolla bort eller trolla fram något. (Hade annars varit kul, då hade man kunna trolla fram Au eller Pt i stora mängder. Eller trolla bort CO2 från atmosfären...)
Så, slarva inte!!! Du glömde natriumacetat
CH₃COOH + NaHCO₃ → Na+CH3COO- + CO2 + H2O
Det är hela kemiska reaktionen.
Du kan skriva i din rapport att CO2 övergår till gasfasen.
B) I nästa delen (och blanda inte med det första!) vill du isolera produkten natriumacetat.
Det gör du genom filtrera bort olösliga delar i bakpulver (mest stärkelse).
När du torkar filtratet evaporerar vatten och eventuell lösta små mängder av kolsyra.
Kvar är ... natriumacetat plus lösliga salter från bakpulvret antagligen svaga syrorna som nämns i wiki artikeln.
Man brukar egentligen inte skriver en kemisk formel för avdunstningen av vatten det gäller mer som en fysikalisk process.
Men om du vill kan du skriva så här:
Na+CH3COO- (aq) → Na+CH3COO- (s)
Du kan jämföra bilden av dina acetat kristaller med bilder från rena acetat kristaller .
Det som man ser att färgen är vit, som det ska.
Kristallisation gav inga stora kristaller, men man kan ser en tendens till mer fiberaktiga kristaller.
Men något som är typiskt för natriumacetat syns vilket är den vita sidenglans.
Lycka till nu!
Och var noggrann med alla siffror och tecken som behövs sätta högre eller ned. :)
https://sv.m.wikipedia.org/wiki/Fil:Natriumacetat_Kristalle.JPG
Zockimon skrev:Tack för bilden, vad spännande! :)
A) Angående reaktionen... Det saknas något.
Som en enkel regel vid stökiometriska kemiska formler måste alltid antal atomer på vänster sidan vara lika stor som på höger sidan.
Man kan inte trolla bort eller trolla fram något. (Hade annars varit kul, då hade man kunna trolla fram Au eller Pt i stora mängder. Eller trolla bort CO2 från atmosfären...)Så, slarva inte!!! Du glömde natriumacetat
CH₃COOH + NaHCO₃ → Na+CH3COO- + CO2 + H2ODet är hela kemiska reaktionen.
Du kan skriva i din rapport att CO2 övergår till gasfasen.
B) I nästa delen (och blanda inte med det första!) vill du isolera produkten natriumacetat.
Det gör du genom filtrera bort olösliga delar i bakpulver (mest stärkelse).
När du torkar filtratet evaporerar vatten och eventuell lösta små mängder av kolsyra.
Kvar är ... natriumacetat plus lösliga salter från bakpulvret antagligen svaga syrorna som nämns i wiki artikeln.Man brukar egentligen inte skriver en kemisk formel för avdunstningen av vatten det gäller mer som en fysikalisk process.
Men om du vill kan du skriva så här:
Na+CH3COO- (aq) → Na+CH3COO- (s)
Du kan jämföra bilden av dina acetat kristaller med bilder från rena acetat kristaller .
Det som man ser att färgen är vit, som det ska.
Kristallisation gav inga stora kristaller, men man kan ser en tendens till mer fiberaktiga kristaller.
Men något som är typiskt för natriumacetat syns vilket är den vita sidenglans.
Lycka till nu!
Och var noggrann med alla siffror och tecken som behövs sätta högre eller ned. :)
https://sv.m.wikipedia.org/wiki/Fil:Natriumacetat_Kristalle.JPG
Tusen tack för hjälpen! :)


