kokpunkter
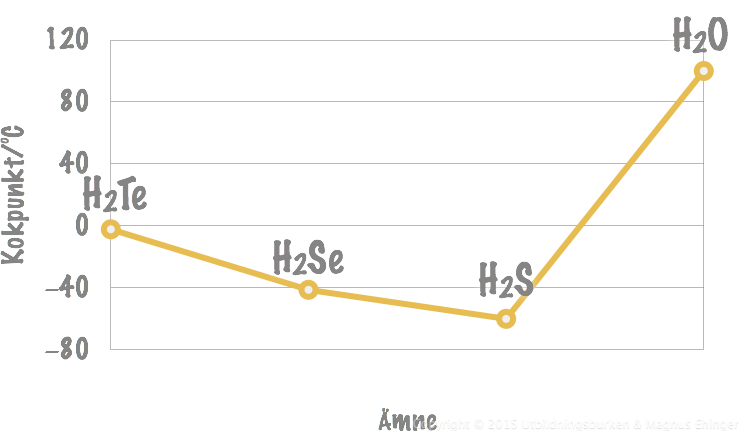
Vad är förklaringen mellan kokpunkterna mellan H2Te, H2Se, H2S? Jag kan förklara varför H2O är så avvikande.
Desto starkare den intermolekylära bindningen är, desto högre kokpunkt har ämnet. Dipol-dipol bindningar är starkare än rena, fullständiga kovalenta bindningar. Därför bör väl H2S ha en högre kokpunkt än H2Te då H2Te är i princip en perfekt kovalent binding medans H2S iallafall har en svag 0.4 skillnad i elektronegativitet..
Kovalent och polär kovalent bindning är intramolekylära bindningar.
H2Te, H2Se och H2S är väl alla polära molekyler och det finns således dipol-dipol interaktioner och vdW interaktioner mellan sådana molekyler. Te, Se och S är alla i samma grupp i periodiska systemet. Kan man dra någon slutsats utifrån det? Te har flest elektroner som kan ge totalt sett starkare interaktioner (dipol-dipol, vdW) vilket skulle bidra till högre kokpunkt än H2Se och H2S.
(Nu är ju O också in den gruppen, dessutom längst upp, men vatten är speciellt pga den starka dipol-dipolinteraktion vi kallar vätebindning...)


