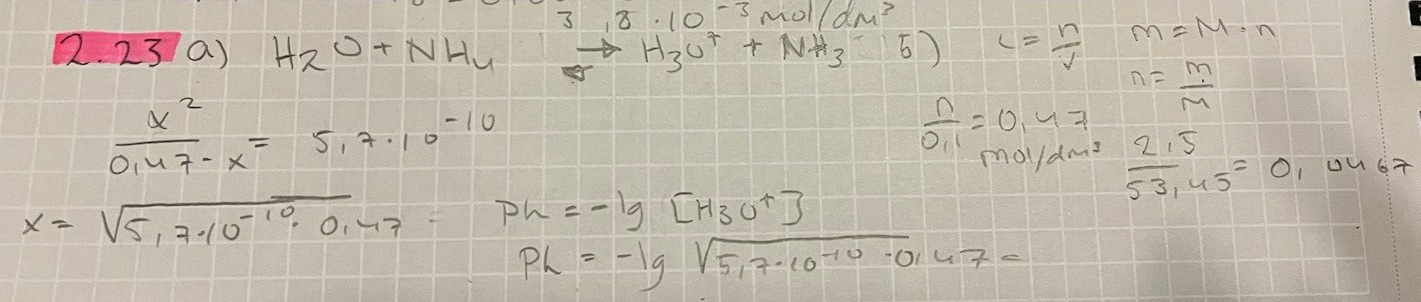Kemisk Jämvikt. (Ph värde av ammoniumklorid i vattenlösning)
2.23 Man löser 2,50 g ammoniumklorid NHACI
i så mycket vatten att lösningens volym blir
100 cm^3. Vid den rådande temperaturen är
Ka, för NH4^+ 5,7 • 10^-10 mol/dm^3
b Vilket pH har vattenlösningen av
ammoniumklorid.
svaret ska bli 4,79 men får det dubbelt så högt. Skulle uppskatta att få hjälp!

Lillyyan skrev:2.23 Man löser 2,50 g ammoniumklorid NHACI
i så mycket vatten att lösningens volym blir
100 cm^3. Vid den rådande temperaturen är
Ka, för NH4^+ 5,7 • 10^-10 mol/dm^3b Vilket pH har vattenlösningen av
ammoniumklorid.svaret ska bli 4,79 men får det dubbelt så högt. Skulle uppskatta att få hjälp!
Reaktionsformeln är NH4+ + H2O <=> NH3 + H3O+ (glöm inte laddningarna!)
Molmassan för ammoniumklorid är 4.1+14+35.5 = 53,5 g/mol så 2,5 g är 0,0467 mol och koncentrationen är 0,467 mol/dm3.
Ditt uttryck för jämviktskonstanten ser korrekt ut. Du verkar ha försummat x jämfört med 0,47 utan att motivera det. När jag beräknar värdet på ditt x och räknar om det till pH så får jag 4,79. Vad fick du för värde, och hur slog du in det på räknaren?
Hej! Tack för att du hjälpte mig. X ä försumbart eftersom HAc är en svag syra och x är försumbart litet i förhållande till 0,47 mol/dm^3. Testade att slå in det igen med tillräckligt många parenteser och då blev det rätt svar. Ska komma ihåg laddningarna:) tack för hjälpen igen!