Kemi 1 uppgift
Hej! Jag pluggar till mitt första kemiprov (kemi 1 på gymnasiet). Jag har en uppgift som jag skulle behöva hjälp med. Jag förstår att man ska jämför med kvävet och på så sätt komma fram till vad som sker men sen hänger jag inte riktig med på varför/hur allt sker.
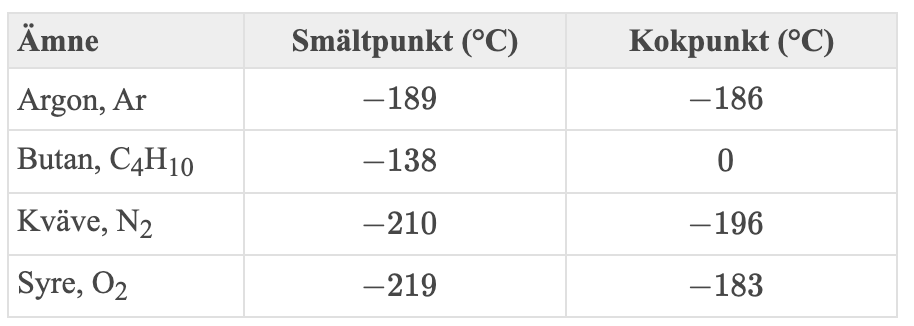
"Flytande kväve används ofta som kylmedel. Man sänker ned ballonger med vart och ett av ämnen i tabellen nedan i ett öppet kärl med flytande kväve. Kärlet står i rumstemperatur och innan man sänker ner ballongerna i det flytande kvävet har ballongerna rumstemperatur".
- Vad händer med den temperatur som det flytande kvävet har i kärlet?
- Vad händer med ämnena i ballongerna?
Punkt 1: Kan vätskan bli varmare än sin kokpunkt? Jmf med om du t.ex. kokar vatten, blir det varmare än 100 grader?
Punkt 2: Här får du resonera kring om något ämne kondenserar och sen eventuellt stelnar. Det sker om omgivningen har en temperatur lägre än kokpunkten/smältpunkten.
Tack för svar! Den första punkten förstår jag. Men på den andra punkten är väll svaret bara att kvävets temperatur kommer vara varmare då det frigörs värme från de olika fasomvandlingarna som sker i ballongerna?
Sen förstår jag inte heller varför kväveballongen kommer krympa när man tar ner den i kärlet.
Kvävet kan inte bli varmare eftersom det redan befinner sig vid kokpunkten. All energi som tillförs går åt till att förånga kvävet.
Om vi kollar på syre så har det kokpunkten -183 grader, alltså högre än kvävets -196 grader. Det innebär att syret kommer att kondensera. Så är det tänkt att du ska resonera.
Att ballongens volym minskar beror dels på just att vissa gaser kondenserar, vätskor har mycket högre densitet än gaser. De ämnen som fortfarande är i gasfas vid -196 grader kommer att ha kylts ner från rumstemperatur. Enligt ideala gaslagen tar en gas också mindre plats när temperaturen sjunker.


