Kan man strunta i den intiala jämvikten?
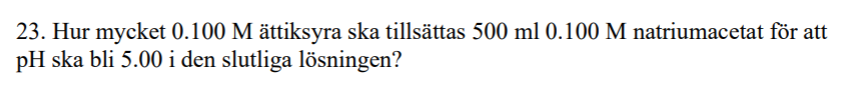
I den ursprungliga lösningen med natriumacetat kommer det ju ställa in sig en jämvikt mellan ättiksyra och acetatjoner. Man kan ju räkna på den för den lösningen separat för att få antal HAc respektive Ac-, och sedan räkna på tillsatsen. Men jag tänkte att man lika gärna kan räkna på "nettomängderna", alltså helt enkelt räkna att när man tillsätter ättiksyralösningen har man i början 0.1 M*0.5 dm3 Ac- och 0.1 M * x HAc. Alltså att man räknar som om 500 mls lösningen inte befann sig i någon jämvikt från början.
Det blev rätt svar men vill ändå bara bekräfta att man kan räkna så.
0,100 M natriumacetat har väl ett pH strax över 7, kanske pH 8. Koncentrationen av ättiksyra innan tillsats av ättiksyralösningen är väl i storleksordningen 10-6 M. Så ja, det är försumbart.
Men jag tänkte att det inte bara blir försumbart, utan borde leda till samma sak. För i slutändan kommer jag ju ha lagt till exakt samma mängder till min lösning, kommer jag inte det?
Men det kanske är knasigt?
För om jag räknar med att en viss mängd Ac- har reagerat till HAc, då kommer jag behöva lägga till mindre HAc än om jag inte räknade med det. Och motsatsen gäller ju också.
Tror jag förstår ungefär hur du menar. Det är inte uppenbart i mitt huvud hur det blir, men det låter rimligt. Du borde kunna bevisa det matematiskt om det stämmer.
Förstår.
Men oavsett är det, så att jag förstår rätt, så att protolysen i respektive lösningar är så himla liten att man kan strunta i den? Alltså både i ättiksyralösningen och natriumacetatlösningen.
Ja precis



