K2) Laboration: estersyntes. Varför sker/gör man detta?
K2) Organisk kemi
Jag har utfört en estersyntes mellan etanol och etansyra (konc.).
När jag nu repeterar den teoretiska delen uppstår det några frågor jag önskar få hjälp att förstå. Jag har delat upp frågorna i tre delar: syntes, destillation och rening.
Syntes
1. När man värmer upp de två reaktanterna, är detta enbart för att katalysera reaktionen eller förändrar detta jämviktsläget på något sätt till förmån för ökat utbyte?
(Syntesen skedde i närvaro av konc. svavelsyra som katalysator).
2. Återloppskokning. Är den enda orsaken till den att man vill få etanolen att fortsätta reagera och förhindra att den förångas ut till uppsamlingskärlet?
3. Bladningen kokades under 20 minuter och skulle sedan svalna. Varför?
Enda anledningen jag kan komma på (som ändå verkar orimlig) är att man vill förhindra att svavelsyran når sin kokpunkt.
Destillation
1. Etyletanoat har kokpunkten 77,1 gr. C. medan etanol har kokpunkten 78,4 gr. C. Vi slog av värmen så fort vi nådde strax över 77 gr. C. (hos ångorna) för att så mycket som möjligt av etyletanoaten skulle syntentiseras medan halten etanol i slutprodukten skulle vara så liten som möjligt. Låter detta vettigt?
När jag läser laborationsinstruktionen står det dock så här:
"Värm så att blandningen börjar koka. Då destillera vätska över i förlaget. Öka värmen när destillationen verkar upphöra. Fortsätt att destillera till dess att temperaturen stigit till ca 100 grader Celsius. Stäng av värmen."
I efterhand förstår jag dock ej hur de tänker här.
Vi har i början 16 g etanol och 16 g etansyra, vilket motsvarar 0,347 respektive 0,266 mol. Etansyra är alltså begränsande. När all den har reagerat och format estern finns etanol kvar. Om man fortsätter över etanolens kokpunkt hamnar det etanol i uppsamlingskärlet? Även om det renas senare är det väl ej att föredra?
Rening
Rening utfördes i två steg. Upplys mig gärna om jag förstått orsaken till dessa två steg rätt.
1. Destillatet blandades med natriumkarbonatlösning och skakades. Eftersom det kan finnas lite ättiksyra kvar vill man redan bort den. Den kommer att protolyseras och bilda negativa joner som kommer att attraheras till den vattenfas som uppstår. Rätt?
2. Man sköljer och tvätta etyletanoaten med avjonat vatten. Varför?
3. Destillatet blandas med kalciumkloridlösning. I instruktionen står det att etanolen skulle binda sig till kalciumjonerna. Jag antar att de syftar på att kalciumjonerna binder till OH-gruppen. Varför är detta nödvändigt? Etanolen är väl vattenlöslig som den är och kan lösa sig i vatten, dvs. röra sig bort från den organiska fasen?
I laborationen föreslår de en omdestillation (vilket jag inte gjorde då lektionen var för kort).
Här står det dock att man ska endast samla upp det som kommer i intervallet 72-78 gr. C. Jag förstår dock ej varför. Vad skulle komma innan? Det jag kan tänka mig kommer efter är etanolen. Har någon nån idé?
Är mycket tacksam om du kommit hit efter denna långa fråga (med många frågor i!) och har tid och möjlighet att besvara dessa då jag gärna vill utveckla min förståelse inom det viktiga ämnet kemi.
Om det är till någon användning att ha laborationsinstruktionerna för svar kan jag bifoga dem. Kommentera nedan isåfall.
Syntes
1. Högre temperatur innebär snabbare reaktion. Men det är fel att säga att det "katalyserar" reaktionen. Katalys innebär att ett ämne snabbar på en reaktion genom att öppna upp en alternativ reaktionsväg. Tänk dig att du var tvungen att åka genom varje kvarter i Stockholm för att passera staden. En katalysator skulle motsvara att man öppnar upp en motorväg bredvid staden som gör att man kan passera mycket snabbare. Lite så fungerar en katalysator...
Genom att öka temperaturen ser man till att fler partiklar har tillräcklig energi för att överkomma aktiveringsenergin och därmed fullborda reaktionen snabbare.
2. Ja, återloppskokning används för att förhindra att lösningsmedlet eller reaktanterna avdunstar/kokar bort.
3. Kan tänka mig att det är en praktisk aspekt, dvs det är enklare att hantera en lösning som har kallnat. Dessutom minskar man avdunstningen om lösningen är kall. När du tar bort blandningen från återloppskokningen kan ju ämnena inte återföras från gasfasen längre.
Destillation
1. Det är praktiskt svårt att separera två vätskor genom destillation när det skiljer så lite i kokpunkt. Ångan kommer ha betydande halt etanol även om du slår av värmen när den är strax över 77 grader. När reaktionen sker så bildas ju vatten, vilket har kokpunkten 100 grader. Då kommer man höja kokpunkten hos blandningen vilket gör att man måste öka temperaturen längre fram under destillationen. Jag tror att det är detta som avses i instruktionen.
Rening
1. Ja det verkar rätt uppfattat. Natriumkarbonat kan reagera med ättiksyra så att det bildas koldioxid, vatten och natriumacetat. Det sistnämnda är ett vattenlösligt salt som kommer lösa sig bättre i vattenfasen än den organiska fasen.
2. Troligen för att tvätta bort rester av polära föroreningar i etylacetaten, t.ex. etanol eller spår av natriumacetat. Dessa löser sig bättre i vattenfasen.
3. Kalciumklorid är känt för att det är väldigt hygroskopiskt, dvs det binder till och tar upp vatten från sin omgivning. Det finns bl.a. i "torrbollar" som man använder för att suga upp fukt från luften i t.ex. källare. Genom att blanda kalciumklorid med etylacetaten kan man binda upp vatten som finns kvar från tidigare separationssteg. Kalciumklorid är ett salt som består av joner och löser sig därför ganska dåligt i den relativt opolära etylacetaten. Därför slipper man problemet att kalciumkloriden skulle lösas upp i etylacetaten.
I laborationen föreslår de en omdestillation (vilket jag inte gjorde då lektionen var för kort).
Här står det dock att man ska endast samla upp det som kommer i intervallet 72-78 gr. C. Jag förstår dock ej varför. Vad skulle komma innan? Det jag kan tänka mig kommer efter är etanolen. Har någon nån idé?
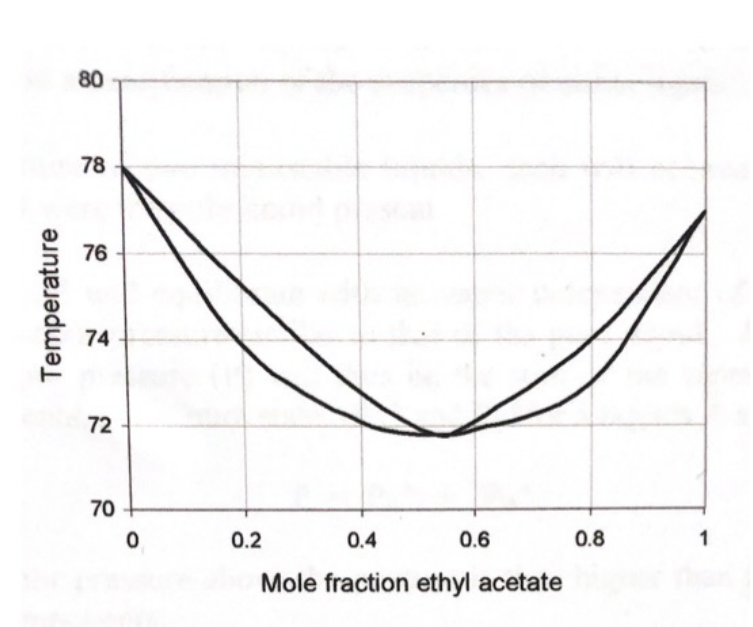
Vid en lägre temperatur kommer en större andel av ångan att bestå av etylacetat eftersom det har något lägre kokpunkt än etanol, och betydligt lägre kokpunkt än vatten. Se grafen nedan som visar ett fasdiagram för systemet etanol-etylacetat. Området nedanför den lägsta kurvan beskriver att blandningen är helt i vätskeform. Området ovanför den övre kurvan beskriver att allt är i gasform (ånga). Området mellan de två kurvorna beskriver att man har en blandning av ånga och vätska.
Man läser av diagrammet såhär: Om du har 20 mol% etylacetat i vätskan (och 80 mol% etanol) kommer den att börja koka vid ca 74 grader. Ångan som bildas vid 74 grader består av ca 30 mol% etylacetat. Om du kondenserar den ångan har du alltså fått upp halten etylacetat från 20 mol% till 30 mol%. Halten ökar alltså ganska lite, vilket beror på att det skiljer så lite i kokpunkt mellan etanol och etylacetat. Skulle man ta vätskan med 30 mol% etylacetat och omdestillera den så skulle den börja koka vid knappt 73 grader och bilda en ånga med 40 mol% etylacetat. Om man fortsätter upprepa destillationen så kommer man till slut att "fastna" i sänkan vid ca 55 mol% etylacetat. Då kan man inte öka halten ytterligare genom destillation. Blandningen kallas då för en azeotrop. I detta fall måste man använda någon annan separationsmetod eller tillsätta ett ämne som bryter azeotropen. Kommer man förbi den azeotropiska punkten kan man fortsätta att destillera till nära 100% ren etylacetat.
För att återgå till din fråga: Att man ska destillera vid lägre temperatur beror helt enkelt på att kokpunkten sänks eftersom du ökar andelen etylacetat. Detta gäller fram till att du har 55 mol% etylacetat i blandningen. Efter det kommer kokpunkten att öka igen.
Tack för att du tog dig tid att skriva detta svar till mig. Jag håller på att läsa igenom det just nu men vill säga att kalciumkloriden som adderades var hydratiserad samt upplöst i vatten. I instruktionen angavs det att den skulle rena bort etanolen som finns kvar. Vad har den för effekt då? Det står "kalciumjonerna befriar etylacetatet från etanol". Hur?
Teraeagle skrev:3. Kalciumklorid är känt för att det är väldigt hygroskopiskt, dvs det binder till och tar upp vatten från sin omgivning. Det finns
bl.a. i "torrbollar" som man använder för att suga upp fukt från luften i t.ex. källare. Genom att blanda kalciumklorid med etylacetaten kan man binda upp vatten som finns kvar från tidigare separationssteg. Kalciumklorid är ett salt som består av joner och löser sig därför ganska dåligt i den relativt opolära etylacetaten. Därför slipper man problemet att kalciumkloriden skulle lösas upp i etylacetaten.
Syntesavsnittet förstår jag precis. Tack för hjälpen med det.
Teraeagle skrev:Destillation
1. Det är praktiskt svårt att separera två vätskor genom destillation när det skiljer så lite i kokpunkt. Ångan kommer ha betydande halt etanol även om du slår av värmen när den är strax över 77 grader. När reaktionen sker så bildas ju vatten, vilket har kokpunkten 100 grader. Då kommer man höja kokpunkten hos blandningen vilket gör att man måste öka temperaturen längre fram under destillationen. Jag tror att det är detta som avses i instruktionen.
Jag förstår inte riktigt det du menar här (fetstil). Är det att i och med att vatten bildas kommer den totala kokpunkten höjas för hela blandningen, vilket innebär att man måste fortsätta över 77 grader för att fortsätta förånga etyletanoat och etanol? Det vill säga att man aldrig kommer ifrån det faktum att det kommer finnas etanol i destillatet, man får helt enkelt rena bort det senare?
Rening
1. Ja det verkar rätt uppfattat. Natriumkarbonat kan reagera med ättiksyra så att det bildas koldioxid, vatten och natriumacetat. Det sistnämnda är ett vattenlösligt salt som kommer lösa sig bättre i vattenfasen än den organiska fasen.
För att vara extra tydlig:
Na2CO3 + HAc → NaAc + H2O + CO2
NaAc→ Na+ + Ac-
Men är inte Ac- redan i protolyserad form i den organiska fasen? Alltså innan man tillsätter natriumkarbonatet. Räcker det inte med att man skakar så att den kommer i kontakt med vatten för att den ska lösa sig där och stanna bland vattenmolekylerna eftersom den är polär?
Reste(r)n (!) förstår jag också. Super tack för det!
Det är möjligt att det beror på det då är inne på, dvs att du får någon sorts jon-dipolbindning mellan jonerna och etanolen som gör att etanolen lättare förs över till vattenfasen.
Jag hittade en artikel "Enhancement of liquid phase splitting of water + ethanol + ethyl acetate mixtures in the presence of a hydrophilic agent or an electrolyte substance" där man skriver såhär introduktionen:
Ethyl acetate has been widely used as a solvent in many industries. It can be synthesized from acetic acid with ethanol over acidic ion-exchange resins via a reactive distillation pro- cess. The products of the esterification are water and ethyl acetate, which are partially miscible, and thus the prod- uct mixtures containing water, ethyl acetate, and ethanol (if ethanol is in large excess) may form two-liquid phase in a certain range of compositions. While the solubility of ethyl acetate is very low in the aqueous phase, substantial amount of water dissolves in the organic-rich phase. It may be economically feasible to the separation purpose, if the heterogeneity region can be increased. As evidenced from previous experimental results, such as Pai and Rao [1], Mali- nowski and Daugulis [2], and Saravanan and Srinivasan [3], adding a salt and/or a hydrophilic agent into the liquid mixtures could be an effective method. Pai and Rao [1] measured the mutual solubilities of water + ethanol + ethyl acetate with- out salt and with saturated salt of potassium acetate, sodium acetate, potassium chloride, sodium chloride, potassium sul- fate, and sodium sulfate at 303.15 K. The results indicated that potassium acetate yielded the highest solubility depression of water in the organic phase. Other data of phase equilibria for some related binary and multicomponent systems available in literatures are listed in Table 1.
The objective of the present study is to investigate the enhancement of phase splitting of the liquid mixtures of water + ethanol + ethyl acetate in the presence of a certain amount of a hydrophilic agent (glycerol) or a salt (either KAc or CaCl2). Phase compositions at liquid–liquid equilibrium (LLE) were measured for various multicomponent aqueous mixtures at temperatures from 283.15 K to 313.15 K over atmospheric pressure. These new LLE data were corre- lated with the Electrolyte-NRTL model [20]. The Electrolyte- NRTL model reduces to the original NRTL model [21] for salt-free systems.
Så vad det handlar om är att du kan få tre faser: etylacetat, vatten och en "blandfas" mellan dem som består av etylacetat och vatten. Det är denna blandfas man försöker motverka genom att tillsätta ett ämne som kalciumklorid. Då blir det lättare att skilja faserna från varandra. Den exakta mekanismen bakom det hela är lite oklar, men det kan som sagt bero på det det du är inne på.
Jag vill förövrigt säga att du förutspådde rätt. Jag tillsatte kalciumklorid i fast form som sista steg för att dra ut vattnet innan vägning och utbytesräkning, men då hade jag redan tillsatt vattenlöst kalciumklorid i steget innan.
Jag ska läsa artikeln som du hittade nu. Jag vet inte hur jag ska tacka dig!!!
Jag förstår inte riktigt det du menar här (fetstil). Är det att i och med att vatten bildas kommer den totala kokpunkten höjas för hela blandningen, vilket innebär att man måste fortsätta över 77 grader för att fortsätta förånga etyletanoat och etanol? Det vill säga att man aldrig kommer ifrån det faktum att det kommer finnas etanol i destillatet, man får helt enkelt rena bort det senare?
Ja, vatten kommer höja kokpunkten hos blandningen. Det är oundvikligt att det hamnar etanol i destilaltet. Man får antingen upprepa destillationen i flera steg eller använda en annan separationsmetod för att bli av med etanolen.
Rening
1. Ja det verkar rätt uppfattat. Natriumkarbonat kan reagera med ättiksyra så att det bildas koldioxid, vatten och natriumacetat. Det sistnämnda är ett vattenlösligt salt som kommer lösa sig bättre i vattenfasen än den organiska fasen.
För att vara extra tydlig:
Na2CO3 + HAc → NaAc + H2O + CO2
NaAc→ Na+ + Ac-
Hade det inte räckt med att man tillsätter vatten till den organiska fasen och skakar om? Syran kommer då att protolyseras och stanna kvar i vattnet då jonen blir polär utan att man behöver tillsätta natriumkarbonat. Eller är det någon detalj som jag missar?
Ättiksyra är en svag syra, i vatten existerar den nästan helt som ättiksyramolekyler och bara i liten grad som vätejoner och acetatjoner. Det skulle alltså vara en ganska ineffektiv metod.
Juste, hade helt glömt bort den aspekten.
Tack så mycket för hjälpen Teraeagle!