K2) Aminosyror, Ip ≈ 6
K2) Syror och baser
Jag har läst till mig att neutrala sidokedjor på en aminosyra ger syran Ip ≈ 6 eftersom karboxylsyran är mer sur än vad amingruppen är basisk. Jag förstår att det har med pKa och pKb för de båda, men kan själv inte formulera en slutsats.
Skulle någon kunna motivera detta och klargöra med hjälp av kemiteori?
Tack på förhand.
Inte riktigt med på vad din fråga är. Kring pH 6 är karboxylgruppen protolyserad, och aminogruppen protonerad, i den genomsnittliga aminosyramolekylen.
Hej!
Magnus Ehinger skriver (och säger) att anledningen till att en aminosyra inte är totalt sett oladdad vid pH 7, utan vid pH 6, är att karboxylsyran är mer sur än vad amingruppen är basisk då vid 7.
Jag undrar hur man kan motivera det med hjälp av pKa och pKb för karboxylsyran och amingruppen (eller kvävet), vilket jag förmodar förklarar denna förskjutning.
Hoppas det blev tydligare.
Tillägg: 18 maj 2024 21:49
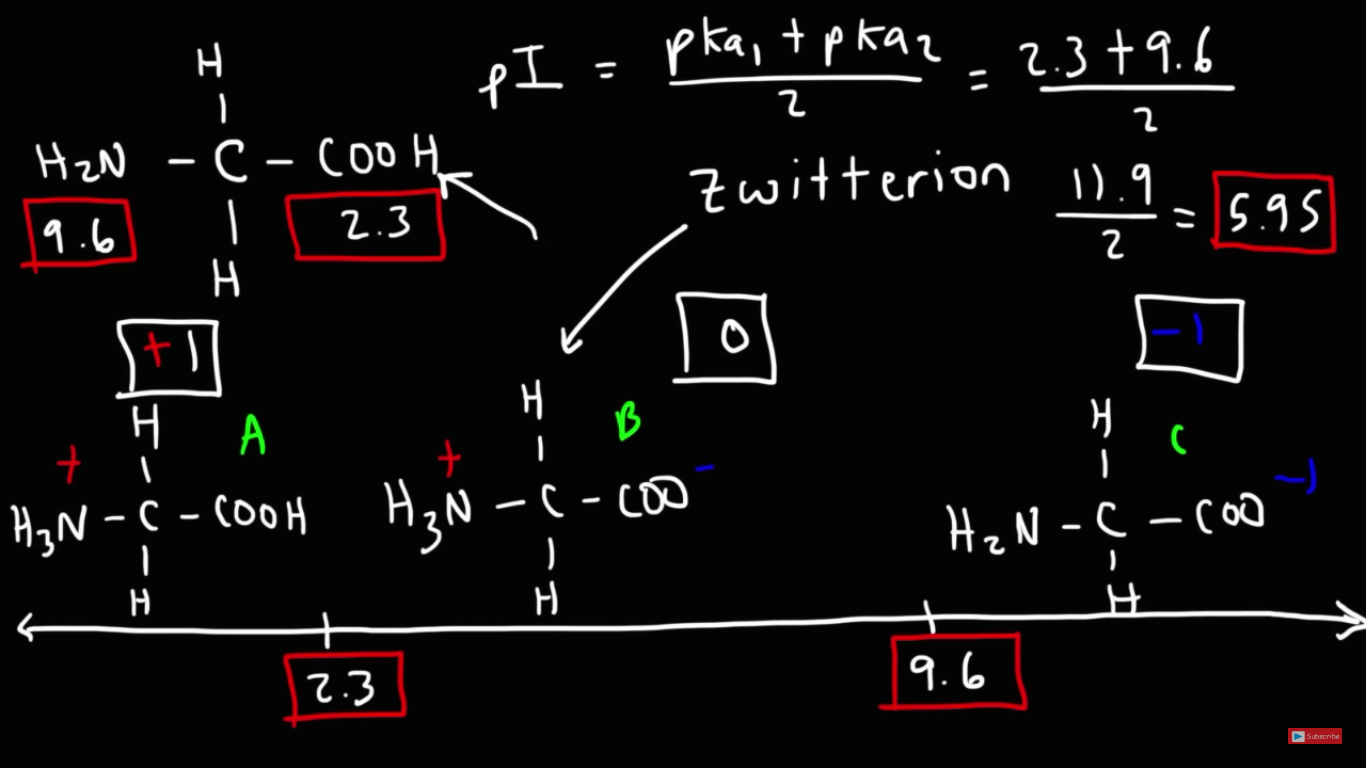
Alltså en total laddning på 0.
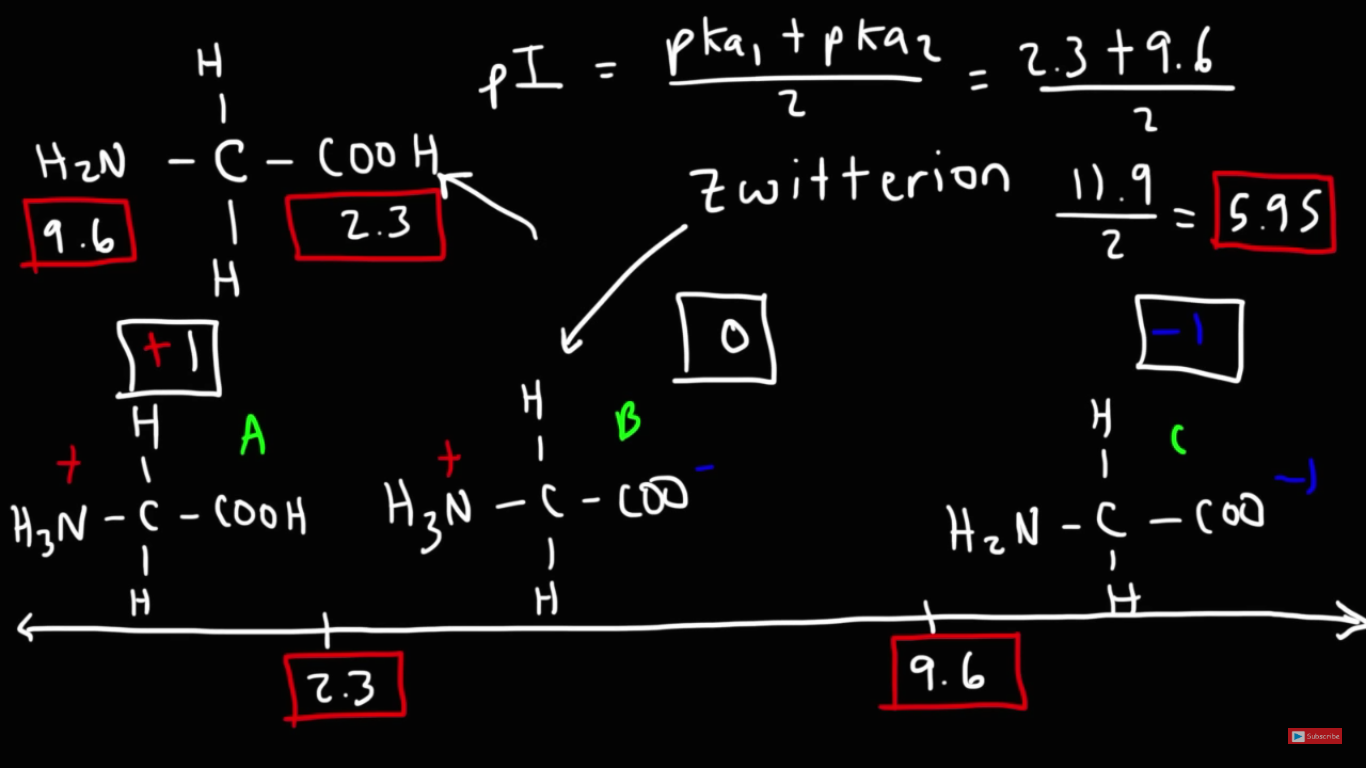
Det blir nog enklare att greppa med ett exempel, t.ex. valin med pKa värdena 2,3 och 9,6. Ofta används pKa värden även för att beskriva basers styrka, genom deras korresponderande syras styrka, och i detta fall vid pH 6 kommer basen/aminogruppen att ha tagit upp en proton och alltså vara i sin laddade syraform.
Så vid pH 6 är det då 3,7 pH enheter ifrån karboxylssyrans pKa och 3,6 ifrån basens pKa - det är m.a.o. lite större avvikelse ifrån karboxylgruppens pKa (då den tar upp protonen och tappar laddningen), jämfört med avvikelsen ifrån aminogruppens pKa.
Så man kan säga att vid pH 6 finnes mellanläget mellan de båda pKa, vilket gör att den isoelektriska punkten förekommer där?
Går det att förklara med hjälp av en titreringskurva på något sätt?
Jag känner att jag fortfarande inte kan greppa konceptet fullt ut.
Tack på förhand.
Ja det skulle man kunna säga.
IP är en summa av båda gruppernas protolysering, så titreringskurvan blir en kombination. Valinmolekylerna har hela tiden två jämvikter, och det brukar blir lite mer övergreppbart med en grafisk illustration av det.
Nu skiljer sig de exakta pKa värdena lite i bilden (dessa värden är beräknade, och avviker lite från de tidigare värden jag skrev, från Wikipedia), och det beräknade IP är därför även lite högre 6.5 - men trenden för hur dessa grupper protoneras är den viktiga i sammanhanget.
I grafen nedan ser du fördelningen av molekyler med grupperna i sina olika former (t.ex. karboxylgruppen i protonerad respektive protolyserad form) som finns vid de olika pH.

Vid pH 6 finns inget av -COOH gruppen (endast -COO-), och aminogruppen finns endast som -NH3+.
Men om du tittar vid t.ex. pH 7,5 så börjar det finnas bidrag ifrån en annan form av aminogruppe, andelen av alla valinmolekyler i den oladdade formen (-COO-, -NH3+) minskar och andelen i -1 ökar (-COO-, -NH2). Så nettoladdningen är lite under 0, kanske -0
Och ju högre pH blir desto mer förskjuts detta mot -1 formen. Och rent matematiskt blir laddningen för alla valinmolekyler inte -1 förrns pH är 14. Innan pH 14 finns det hela tiden en jämvikt mellan aminogruppens bas- och syraform, det är därför frågorna brukar skrivas som "vilken form dominerar vid pH 7,5" istället för "vilken är den enda formen som finns vid pH 7,5".
Tack, nu blev det mycket tydligare.
Tror du att man behöver räkna på detta i Ke2?
Min lärare har inte nämnt något om det, men brukar ibland ändå ta med sånt som inte tagits upp tidigare på A-frågorna eftersom "A-nivå innebär att man kan komma på kreativa lösningar" till olika problem, vilket i vissa sammanhang gör det mycket stressigt inför ett prov.
Nej det kommer nog inte på gymnasienivå. Det är syra/baskemi som ingår i Ke1/2, men med amfolyten blir det lite mer komplicerat. Har ni inte gått igenom detta så skulle jag inte lägga mer energi på detta. Det var mest för förståelsen som jag infogade bilden.
Grymt.
Tack för hjälpen.
Jag har en fråga angående detta som någorlunda förvirrar mig.
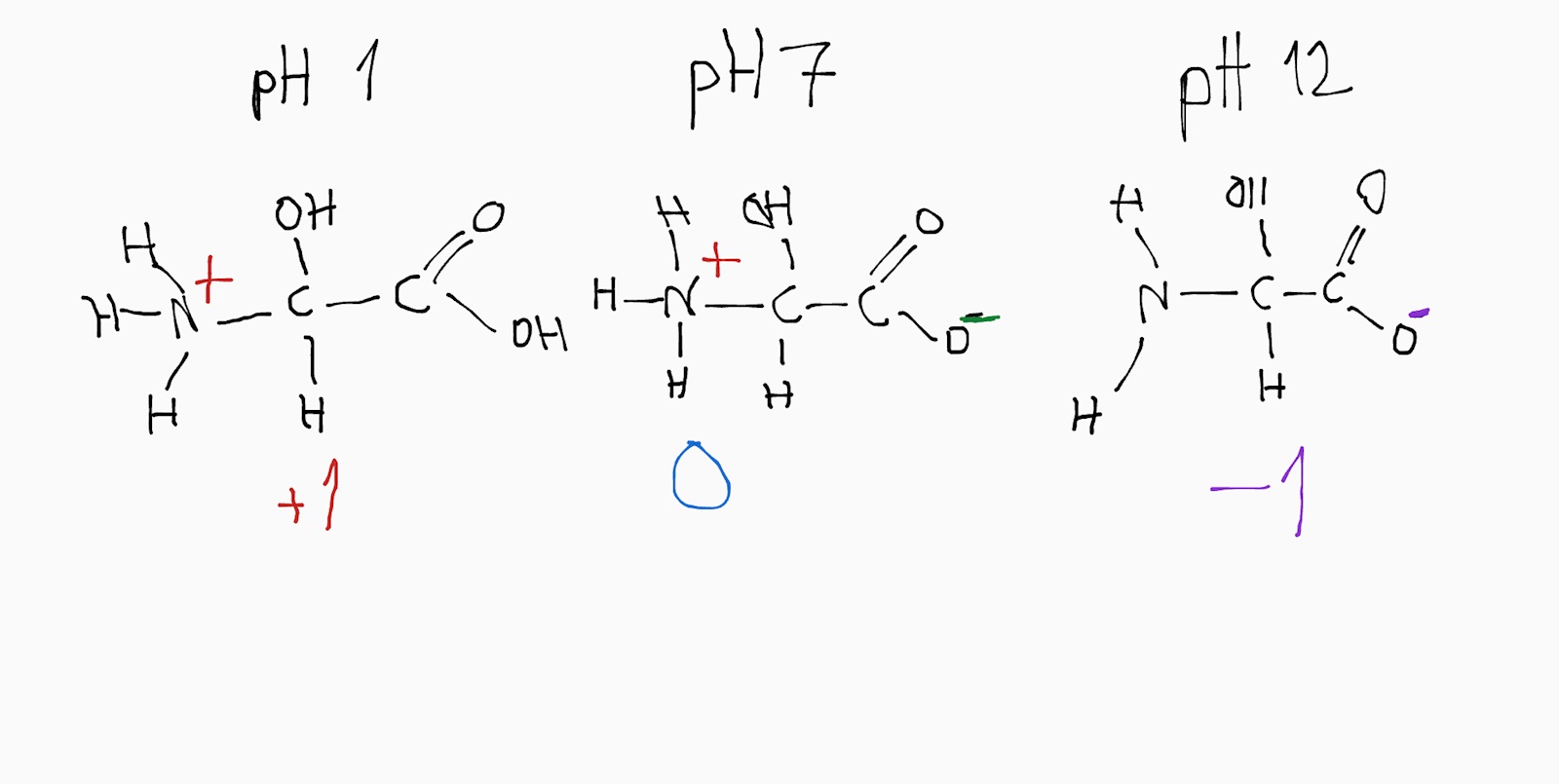
Frågan är: rita strukturformel för glycin vid pH 1, 7 och 12.
pH 1, kommer den att vara positivt laddad.
pH 7 och 12 kommer den att vara negativt laddad.
Det verkar dock konstigt att de inte skriver pH 1, 6, och 12 eftersom det ger tre olika lägen istället för två, eller övertänker jag frågans syfte?
Tillägg: 19 maj 2024 21:33
Facit verkar anta att Ip ligger vid 7, vilket inte stämmer...eller? Där står det de tre fallen jag funderade på. Hur tycker du man ska göra vid examinationer? Försöka tolka det de skriver eller gå på fakta?
Enligt WolframAlpha ligger pH i blod runt 7,4, så det verkar mer intressant att veta hur aminosyror beter sig när pH = 7 än när det är 6.
Tack för svar, men såg du mitt tillägg?
Nja vid pH 7 är den inte negativt laddad. Teoretiskt kan man uttala sig om en molekyl, som i frågan. Och en enstaka molekyl kan ha en laddning av antingen +1, 0, -1.
Men om du betraktar "genomsnittsaminosyra" vid pH 7, så är den utan laddning. Det finns även de andra formerna med i betydligt mindre andelar. Så för "en molekyl" behöver du svara för vad som är "mest rimligt" för genomsnittsmolekylen. Och vid pH 7 är det att laddningen är noll.
Ofta används pH, pKa etcetera för en molekyl, men dessa värden är baserade på en hel massa molekyler/joner samtidigt - värdena motsvarar hur den "genomsnittliga" molekylen beter sig bland alla andra.
Men vid Ip 6, innebär det inte att den då är neutral? Eller missförstår jag dina tidigare svar?
Eller ska man tänka att vid pH 7 finns det ju lika mycket H+ som OH- och därför blir laddning 0? Men då fallerar min tidigare förståelse av Ip...
Hade varit supertacksam om du kunde klargöra. Har du någon video jag kan kolla på för att kanske förstå mer?
Kanske rörde till det lite. Min poäng var att vid pH 6 och pH 7 kommer laddningen anses vara noll för aminosyran. Alla molekyler kommer inte att ha exakt samma laddning, vissa kommer ha laddningen 0, andra -1 och vissa +1. Men den oladdade formen av amfolyten kommer dominera.
Nu har jag kollat på en video som beskriver att man ska tänka i ett intervall som baseras på pKa för basen och syran och utifrån detta själv räkna ut Ip. Det verkar logiskt och hänger ihop väl med det vi diskuterade imorse. Rekommenderar du det?
Se intervallet i underkant på tallinjen.
Tillägg: 19 maj 2024 22:05
Men ett problem uppstår med detta eftersom det inte finns pKa-värden för alla aminosyror i formelsamlingen. Man kan därför inte rita upp en tallinje. Jag känner mig vilse i nuläget. Jag kanske rör till det för mig själv.
Jag löser ett exempel här; Serin:
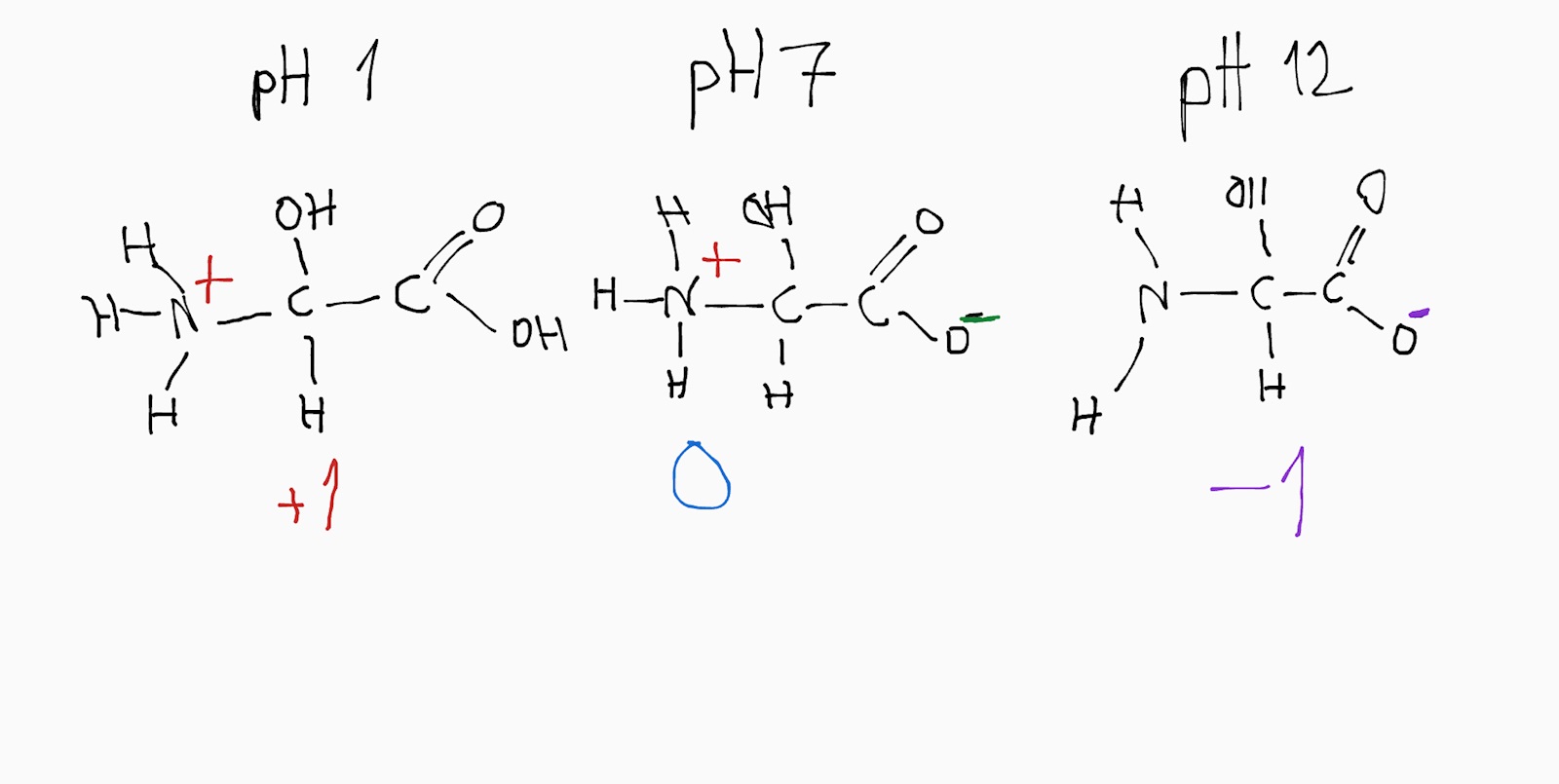
Är anledningen till varför amingruppen inte tar upp H+ i basiska förhållanden att hydroxidjoner är mycket starkare bas än amingruppen och därför tas alla vätejoner upp av dem?
Mesopotamia skrev:Nu har jag kollat på en video som beskriver att man ska tänka i ett intervall som baseras på pKa för basen och syran och utifrån detta själv räkna ut Ip. Det verkar logiskt och hänger ihop väl med det vi diskuterade imorse. Rekommenderar du det?
Se intervallet i underkant på tallinjen.
Tillägg: 19 maj 2024 22:05
Men ett problem uppstår med detta eftersom det inte finns pKa-värden för alla aminosyror i formelsamlingen. Man kan därför inte rita upp en tallinje. Jag känner mig vilse i nuläget. Jag kanske rör till det för mig själv.
Ja formeln fungerar bra för att beräkna IP.
Jag tror du gör det lite för komplicerat för di själv. Det är nog sällan man behöver gå så lång som att beräkna IP från aminosyrans olika pKa. Ofta räcker det med trenden:
Sura aminosyror är sura vid neutalt pH.
Neutrala är neutrala vid pH 7.
Basiska är positiva vid pH 7.
Utifrån det kan du besvara "vilken laddning har valin vid pH 2, 6, 11 ?"
Eller vilken aminosyra har högst IP, valin eller arginin?
Mesopotamia skrev:Jag löser ett exempel här; Serin:
Är anledningen till varför amingruppen inte tar upp H+ i basiska förhållanden att hydroxidjoner är mycket starkare bas än amingruppen och därför tas alla vätejoner upp av dem?
Ja, precis så.
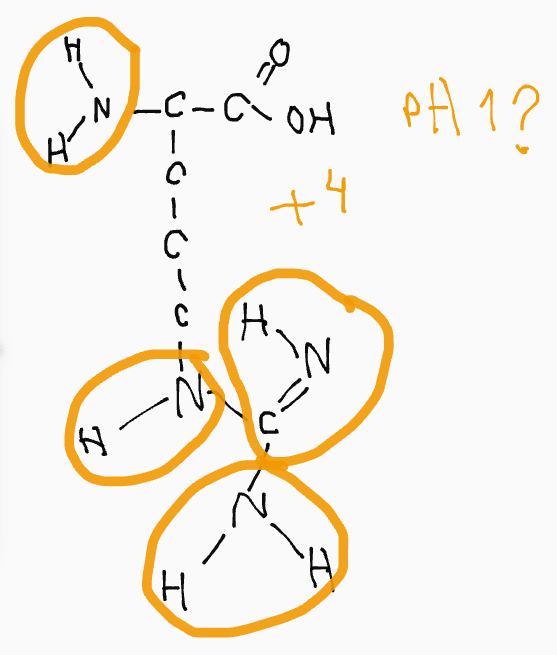
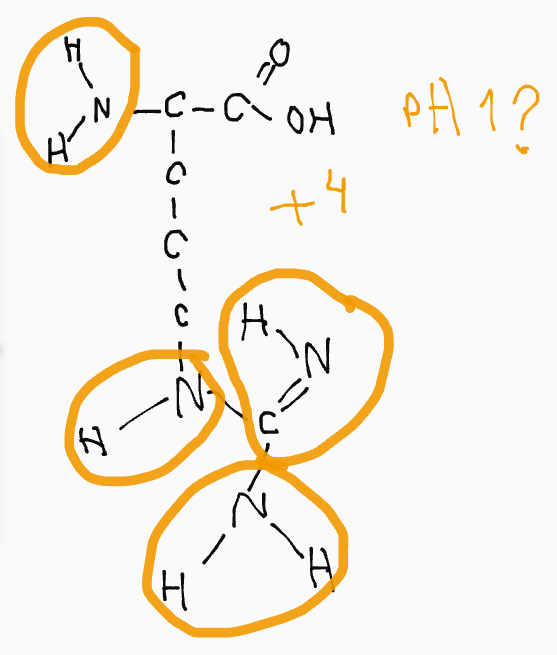
Här känner jag att jag fastnar.
Hittils har jag tänkt att vid varje kväve kan det totalt bindas 4 bindningar till andra atomer, vilket ger kvävet en positiv laddning på +1 (som ammoniumjon). Men det skaver lite, är det verkligen så? Eller måste det vara fyra väte för att laddningen ska bli +1, om inte, förblir den som den är? Klurigt.
Nu har jag funderat mer angående kvävets laddning, och börjar komma fram till att om den inte är bunden till 4 st. väte borde den inte få en positiv laddning, eftersom skillnaden i elektronegativitet mellan kväve och kol inte är lika stor som hos FON. Rätta mig gärna om jag tänker fel.
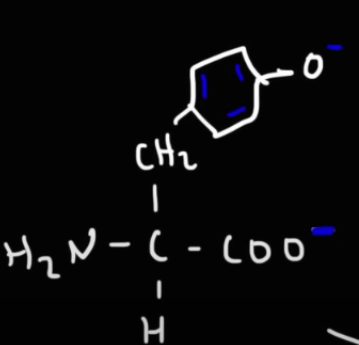
Om man tittar på Tyrosin, hur kan vätet på fenolen avges?
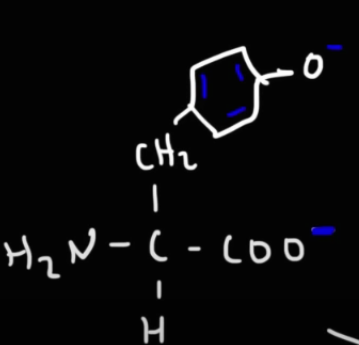
Den är väl ingen karboxylgrupp? I videon sägs det att det sker vid pKa 10.5, men efter vår diskussion igår bestämde jag mig för att sluta röra till det och tänka som du skrev, men i detta fall hade jag inte tänkt att den skulle tappas.
Mesopotamia skrev:
Här känner jag att jag fastnar.
Hittils har jag tänkt att vid varje kväve kan det totalt bindas 4 bindningar till andra atomer, vilket ger kvävet en positiv laddning på +1 (som ammoniumjon). Men det skaver lite, är det verkligen så? Eller måste det vara fyra väte för att laddningen ska bli +1, om inte, förblir den som den är? Klurigt.
Generellt blir laddningen +1 när fyra bindningar bildas från kväve (det finns nog undantag men jag kommer inte på ett nu).
Men sidokedjan i arginin tar endast upp en proton, trots att det finns tre kväven. Anledningen till denna begränsning är dubbelbindningen från kolatomen - som är delokaliserad mellan kolatomen och de tre kvävena.
Gällande antalet väte-bindningar som kan skapas är det fler, i princip han varje väte som binder till kvävena skapa varsin bindning, inklusive det "extra" som finns bundet vid neutralt pH.
Jag förstår. Ska man lära sig utantill för vilka aminosyror detta sker eller finns det något trick? Alltså vilka kväven som blir laddade eller ej.
Mesopotamia skrev:Om man tittar på Tyrosin, hur kan vätet på fenolen avges?
Den är väl ingen karboxylgrupp? I videon sägs det att det sker vid pKa 10.5, men efter vår diskussion igår bestämde jag mig för att sluta röra till det och tänka som du skrev, men i detta fall hade jag inte tänkt att den skulle tappas.
Fenylgruppen (sidokedjan) bidrar med egenskapen att, alkoholen är surare än andra icke-aromatiska alkoholer. Etanol har t.ex. ett pKa på ~16, så mindre surt än både vatten och fenol.
Vid protolysering kan den negativa laddningen delokaliseras till benzenringen, och därför blir denna alkohol surare än andra.
Nu blev det klarare, ang. tyrosinet, men frågan blir varför det står att den har en polär men oladdad sidokedja i formelsamlingen? Är detta felskrivning? För den blir ju uppenbart laddad vid vissa pH...
Det är helt enkelt så att klassificeringen av aminosyrorna är baserad på deras egenskaper vid fysiologiskt (pH 7.4) och neutralt pH.
En av aminosyrornas egenskaper är att deras laddning påverkas av just pH, och pH i bl.a. våra celler kring 7, därför används detta pH som referenspunkt/laddning.
Ah.
Det förvirrar mig att de ibland ritar upp laddning och ibland inte i formelsamlingen. För enligt referenspunkten vid pH 7 borde väldigt många av dessa vara utritade i Zwitterjonform, men de gör det inte. Ska jag bortse från detta och tänka att i den sista rubriken vill de vara extra tydliga?
Ursäkta om jag ställer dumma frågor.
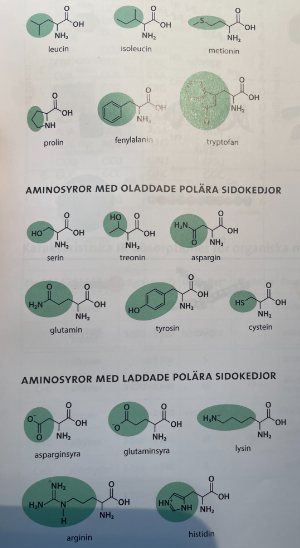
De verkar bara ha ritat ut laddningen för sidokedjorna (vid pH ~7), men inte för de generella amino- och karboxylgrupperna. Ofta visas zwitterjonens laddningar i en generell bild som förekommer den du visat.
Du vet ju att amino- och karboxylgrupperna är laddade vid pH 7, som du var inne på. Men på ett prov eller liknande behöver du rita ut dessa laddningar, även om figurmakaren valde att inte rita ut dem i bilden.
Ofta diskuteras inte de fria aminosyrorna, utan peptider eller proteiner - där i princip endast protoneringen aminosyraresternas sidokedjor är av intresse (samt N- och C- terminalerna), för när peptidbindningen bildats förloras laddningarna hos de grupperna.
Då har jag förstått.
En sista sak bara, vid peptidbindningen, visst kan det inte adderas något väte i praktikten till kvävet som deltar i bindningen? Man ska bara tänka på N-/C-terminalerna och sidokedjorna för det är endast där som förändrar i laddning kan ske förstår jag av det du skriver.
Mesopotamia skrev:Då har jag förstått.
En sista sak bara, vid peptidbindningen, visst kan det inte adderas något väte i praktikten till kvävet som deltar i bindningen?
Nej i praktiken kan inte ett ytterligare väte bindas. Vid låga pH kommer istället karbonylgruppen protoneras.
Man ska bara tänka på N-/C-terminalerna och sidokedjorna för det är endast där som förändrar i laddning kan ske förstår jag av det du skriver.
Ja precis.
Hej mag1!
Jag vill tacka dig för mycket lärorik information i denna tråd.
Själv hade jag stor nytta av den; hoppas andra också får det.
Tack.
För all del Mesopotamia! Kul att det var givande. Och informationen finns kvar på forumet, så förhoppningsvis hittar andra användare hit och (igen) förhoppningsvis kommer resonemangen vi hade till nytta för dem.