joniseringsenergi
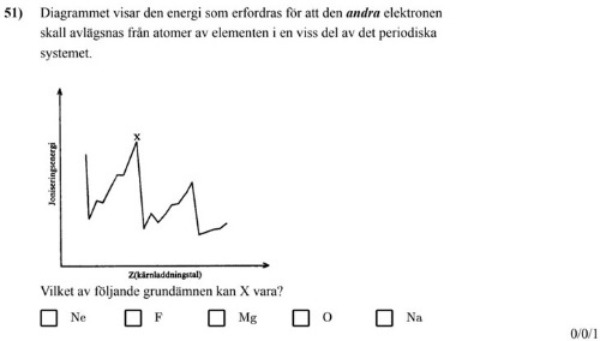 Vad betyder alla värden i diagrammet och hur ska man tänka för att lösa uppgiften? Står x för atomen i sitt ursprungliga tillstånd? Är det så att joniseringsenergin minskar kraftigt när kärnladdningstalet ökar eftersom det snarare avges än kräver energi att avge den första elektronen - och sedan att det ökar när den andra elektronen avges?
Vad betyder alla värden i diagrammet och hur ska man tänka för att lösa uppgiften? Står x för atomen i sitt ursprungliga tillstånd? Är det så att joniseringsenergin minskar kraftigt när kärnladdningstalet ökar eftersom det snarare avges än kräver energi att avge den första elektronen - och sedan att det ökar när den andra elektronen avges?
ankan01 skrev:
Vad betyder alla värden i diagrammet och hur ska man tänka för att lösa uppgiften? Står x för atomen i sitt ursprungliga tillstånd? Är det så att joniseringsenergin minskar kraftigt när kärnladdningstalet ökar eftersom det snarare avges än kräver energi att avge den första elektronen - och sedan att det ökar när den andra elektronen avges?
Det är som svårast att dra bort en elektron från en atom eller jon som har ädelgasskal. Du vill alltså hitta ett grundämne där det var lätt att dra bort den första elektronen, men där den andra sitter som berget...
Ok, då kan jag utesluta F och O eftersom de hellre tar upp elektroner, och sedan Ne då det är en ädelgas. Det står mellan Mg och Na. Jag vet att det krävs mer energi att dra bort den andra elektronen hos båda atomerna, så hur ska jag veta vilken av dessa ämnen det är om jag inte vet något förhållande i diagrammet?
Nej, hos en av Mg och Na är det jättesvårt att dra bort en andra elektron, eftersom det skulle förstöra ett ädelgasskal, men hos den andra är det förhållandevis enkelt - svårare än den första elektronen, men inte så förfärligt mycket.
Jag förstår, det är ju Na. Har svårt att koppla detta till diagrammet dock, vad visar varje "topp"?


