jämvikt
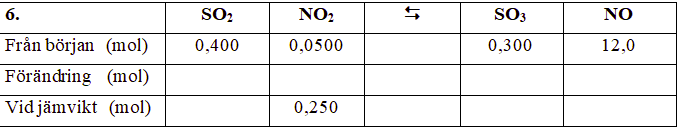
Hur ska jag fylla i rutorna i den här jämvikten? Det som jag först måste ta reda är åt vilket håll reaktionen går åt, men jag vet inte hur jag gör det
För att ta reda på åt vilket håll reaktionen går, kan du titta på substansmängden NO2 från början och vid jämvikt. Har substansmängden ökat eller minskat? Kommer reaktionen att gå åt höger eller vänster?
Substansmängden NO2 har ökat, vilket borde betyda att substansmängden SO3 och NO minskar, dvs att reaktionen går åt vänster
Ja. Hur mycket NO2 bildas vid reaktionen? Hur mycket SO2 bildas samtidigt? Hur mycket SO3 och NO förbrukas?
Det bildas 0,200 mol NO2, jag är dock osäker på hur man beräknar förändringen i substansmängd för övriga ämnen i reaktionen
Hur ser reaktionsformeln ut?
Om det går åt 1 molekyl SO3 och 1 molekyl NO bildas 1 molekyl NO2 och 1 molekyl SO2
Det stämmer. Om det bildas 0,2 mol av NO2 och 0,2 mol SO2, hur mycket förbrukas det av SO3 och NO?
Hur mycket finns det av de fyra ämnena vid jämvikt?
Jaha det handlar om molförhållanden. Eftersom det är 1:1 i reaktionen så har det förbrukats 0,2 mol SO3 och 0,2 mol NO
Ja. Jag upprepar frågan:
Hur mycket finns det av de fyra ämnena vid jämvikt?
Är uppgiften att bestämma jämviktskonstanten, eller vad?
Nej, det är bara en övning med att balansera jämvikter. Hursomhelst så löste jag den nu :)
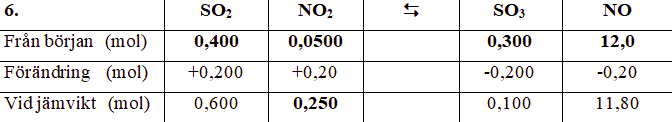
Bara en grej till; Med utgångspunkt ur molförhållanden förstår jag att substansmängden NO2 respektive SO2 ökar båda med 0,200 mol innan reaktionen når jämvikt, men det känns på ett sätt lite konstigt. Så fort det bildas lite NO2 samt SO2 så borde väl de också reagera och därmed förbrukas, dvs deras substansmängder borde minska lite, inte enbart öka?
Ja, visst sker det en reaktion som går åt höger också, men så länge man är "till höger om jämvikt" så går reaktionen åt vänster snabbare. Vid jämvikt sker reaktionen åt höger och reaktionen åt vänster precis lika snabbt.


