I diagrammet kan du se tre av energinivåerna för en atom.
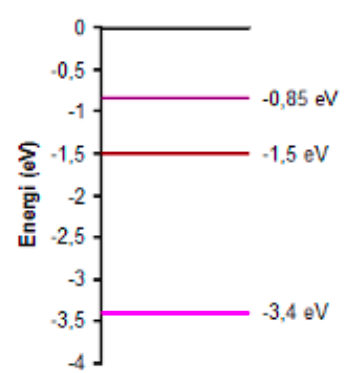
Beräkna tre olika våglängder som atomen av den här typen skulle absorbera om man lyste på den med en ficklampa.
Vet inte hur jag ska tänka, kan någon vägleda mig
tack!
Om en elektron är på en viss energinivå och tar upp en foton med alldeles lagom mycket energi, kan elektronen hoppa upp till en högre energinivå. Om elektronen exempelvis skall hoppa från -3,4 eV till -1,5 eV så behöver man tillföra energimängden 1,9 eV. Hur gör du för att räkna om den energin till frekvens eller våglängd?
Smaragdalena skrev:Om en elektron är på en viss energinivå och tar upp en foton med alldeles lagom mycket energi, kan elektronen hoppa upp till en högre energinivå. Om elektronen exempelvis skall hoppa från -3,4 eV till -1,5 eV så behöver man tillföra energimängden 1,9 eV. Hur gör du för att räkna om den energin till frekvens eller våglängd?
Plancks konstant om vi snackar om fotoner
E= 1,9 eV
h ´= 6,626•10^-34
E => 1,9 eV = 3,044 • 10^-19 Joule
E/h=f => 3,044•10^-19 /( 6,626•10^-34 ) => 4,59• 10^14 Hz
om elektronen hoppar från -3,4 eV till -1,5eV med den tillförda energin 1,9 eV
menar du så här?
Zacko skrev:Smaragdalena skrev:Om en elektron är på en viss energinivå och tar upp en foton med alldeles lagom mycket energi, kan elektronen hoppa upp till en högre energinivå. Om elektronen exempelvis skall hoppa från -3,4 eV till -1,5 eV så behöver man tillföra energimängden 1,9 eV. Hur gör du för att räkna om den energin till frekvens eller våglängd?
Plancks konstant om vi snackar om fotoner
E= 1,9 eV
h ´= 6,626•10^-34
E => 1,9 eV = 3,044 • 10^-19 Joule
E/h=f => 3,044•10^-19 /( 6,626•10^-34 ) => 4,59• 10^14 Hz
Nu vet du frekvensen, men man frågar efter våglängden. Vet du hur man räknar ut våglängden för elektromagnetisk strålning, när man vet frekvensen?
om elektronen hoppar från -3,4 eV till -1,5eV med den tillförda energin 1,9 eV
menar du så här?
Smaragdalena skrev:Zacko skrev:Smaragdalena skrev:Om en elektron är på en viss energinivå och tar upp en foton med alldeles lagom mycket energi, kan elektronen hoppa upp till en högre energinivå. Om elektronen exempelvis skall hoppa från -3,4 eV till -1,5 eV så behöver man tillföra energimängden 1,9 eV. Hur gör du för att räkna om den energin till frekvens eller våglängd?
Plancks konstant om vi snackar om fotoner
E= 1,9 eV
h ´= 6,626•10^-34
E => 1,9 eV = 3,044 • 10^-19 Joule
E/h=f => 3,044•10^-19 /( 6,626•10^-34 ) => 4,59• 10^14 Hz
Nu vet du frekvensen, men man frågar efter våglängden. Vet du hur man räknar ut våglängden för elektromagnetisk strålning, när man vet frekvensen?
om elektronen hoppar från -3,4 eV till -1,5eV med den tillförda energin 1,9 eV
menar du så här?
Nej, vilken formel använder man?
Frekvensen gånger våglängden är lika med utbredningshastigheten
Smaragdalena skrev:Frekvensen gånger våglängden är lika med utbredningshastigheten
Frekvensen är 4,59•10^14 Hz
våglängden , ska jag kolla på den i formelboken, det e ju olika färger, eller går det och veta här pådirekten från uppgiften?
Våglängden kan du lösa ut från formeln som Smaragdlena gav dig, dvs
Vi delar båda led med frekvensen
Så för att få våglängden ska du alltså dela ljusets hastighet med frekvensen .
Vilken färg ljuset har beror på våglängden, 400nm är lila eller violett och 700nm är rött.

D4NIEL skrev:Våglängden kan du lösa ut från formeln som Smaragdlena gav dig, dvs
Vi delar båda led med frekvensen
Så för att få våglängden ska du alltså dela ljusets hastighet med frekvensen .
Vilken färg ljuset har beror på våglängden, 400nm är lila eller violett och 700nm är rött.
Jag får
c/f = => 3•10^8 / 4,59•10^14 => 6,5•10^-7 nm ( alltså 650 vilket e rött)
Eller har jag fel?
Ja, du får vilket är detsamma som vilket är .
Och det var alltså mellan energinivåerna -3.4eV och -1.5eV
Nu kan du beräkna några till.


